Osad

- 2696
- 867
- Pani Waleria Marek
Wyjaśniamy, co to jest osad, reakcja wytrącania, typy, które istnieją i podajemy kilka przykładów
 Powstawanie żółtego osadu podczas mieszania roztworu ze środkiem wytrącającym
Powstawanie żółtego osadu podczas mieszania roztworu ze środkiem wytrącającym Co to jest osad?
A Osad Jest to ciało stałe, które powstaje z roztworu, albo przez krystalizację substancji rozpuszczonej lub przez tworzenie się nierozpuszczalnej substancji poprzez reakcję chemiczną.
Pierwszy przypadek występuje, gdy substancja stała, która początkowo rozpuszczono w rozpuszczalniku, staje się mniej rozpuszczalna. Może się to zdarzyć, kiedy:
- Temperatura roztworu jest obniżona.
- Dodano środek wytrącający.
- Dodano kolejny rozpuszczalnik, w którym ciało stałe jest mniej rozpuszczalne.
Kiedy jego rozpuszczalność staje się mniejsza niż stężenie, roztwór staje się przesycony.
Drugi przypadek występuje po każdej reakcji chemicznej, która generuje nierozpuszczalny lub bardzo mały rozpuszczalny produkt w rozpuszczalniku. Gdy ten produkt zacznie się tworzyć, roztwór jest szybko nasycony, a ciało stałe zaczyna wytrącić.
Reakcja wytrącania chemicznego
Reakcja wytrącania jest procesem chemicznym, który prowadzi do tworzenia osadu. W zależności od tego, jak powstaje osad, reakcję można zapisać na dwa różne sposoby:
- Jeśli opady występuje, ponieważ rozpuszczalność stałego w rozpuszczalniku została zmniejszona (na przykład chłodzenie lub dodanie innego rozpuszczalnika), wówczas reakcja wytrącania obejmuje tylko substancję rozpuszczoną i wyglądałaby tak:

Na przykład, Jeśli octan sodu rozpuszcza się (CH-3Kieszeń) W gorącej wodzie, a następnie pozostawiając ostygnięcie, octan sodu wytrąci się zgodnie z następującym równaniem:

- Jeśli wystąpi opady, ponieważ dodano środek wytrącający, wówczas reakcja wytrącania będzie obejmować zarówno substancję rozpuszczoną, jak i czynnik wytrących.
Na przykład, Jony srebrne (ag+) Mogą wytrącić z roztworu azotanu srebra (Agno3) Dodanie roztworu chlorku sodu lub NaCl (środek wytrących). Reakcję wytrącania w tym przypadku jest podana przez:
Może ci służyć: chlorek niklu (NICL2): struktura, właściwości, uzyskiwanie, użycia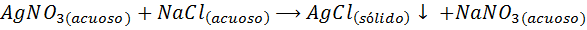
Mechanizm opadów
Niezależnie od reakcji wytrącania, tworzenie osadu zawsze występuje w dwóch etapach zwanych zarodkowaniem i wzrostem:
-
Zarodkowanie
Na początku reakcji wytrącania powstają małe cząstki osadowe, które nazywane są jądrem, więc ten etap nazywa się zarodkową.
-
Wzrost
Po zarodkowaniu nowe cząstki nie są już powstałe, ale jądra już utworzone zaczynają rosnąć, aż opady zatrzymują się.
Rodzaje osadu
Prędkość, z jaką powstają osady, wpływa na wielkość cząstek stałych i właściwości tego samego. W zależności od wielkości cząstek i charakteru wytrącającego się związku można rozróżnić trzy rodzaje osadów:
Krystaliczne osady
Jest to najprostszy rodzaj osadu. W tym przypadku osad składa się z dużych cząstek stałych o średnicy większej niż 0,1 mikrometrów.
 Krystaliczny osad siarczanu miedzi (ii) pentahydratu
Krystaliczny osad siarczanu miedzi (ii) pentahydratu Krystaliczne osady powstają, gdy reakcja wytrącania występuje powoli. Umożliwia to niewiele stałych cząstek podczas zarodkowania, a każda z tych cząstek ma wystarczająco dużo czasu, aby rosnąć i tworzyć duże i ciężkie kryształy, które spadają na dnie roztworu.
Te cząstki są prawie zawsze krystaliczne stałe z płaskimi i jasnymi twarzami, podobnymi do faset diamentu, i prawie zawsze można je odróżnić nagim okiem.
Caseous wytrąca się
Są wytrącane dla znacznie mniejszych cząstek, o średnicy od 0,01 do 0,1. Ten rodzaj osadu powstaje, gdy reakcja wytrącania występuje bardzo szybko, generując wiele cząstek podczas zarodkowania, które nie mają czasu na wzrost.
Ze względu na ich rozmiar cząstki te są bardzo lekkie i są zawieszone w roztworze tworząc stabilny koloid. Z tego powodu nie osiedlają się na dole rozwiązania i wygląda to pochmurno zamiast przezroczystego.
Może ci służyć: dihydroksyaceton: struktura, właściwości, uzyskiwanie, użycia Trzy caseosos w różnych kolorach. Trzy roztwory są mętne po utworzeniu osadów
Trzy caseosos w różnych kolorach. Trzy roztwory są mętne po utworzeniu osadów Oprócz tego cząstki są tak małe, że udaje im się przekroczyć większość filtrów używanych do oddzielenia osadów od roztworów.
Jellyry Hacords
Gdy cząstki są jeszcze mniejsze niż cząsteczki stadionów, to znaczy o średnicach mniejszych niż 0,01 mikrometrów, osady nazywane są galaretką. Powodem jest to, że stała nabywa wygląd podobny do żelatyny lub dżemu.
Te osady są również uważane za koloidy. W rzeczywistości żelatyna jest typowym przykładem koloid.
Charakterystyczne przykłady galaretki są uwodnione tlenki niektórych metali. Te tlenki pochłaniają dużą ilość wody na ich powierzchni, co zapobiega tworzeniu większych cząstek, które krystalizują.
Przykłady wytrącania
Octan sodu (ch3Kieszeń)
Jak wspomniano powyżej, octan sodu można wytrącić z gorącego nasyconego roztworu, który może się chłodzić. Jeśli może to ostygnąć powoli, powstaje krystaliczny osad, w którym obserwuje się długie kryształy białej igły.
Siarczek kadmu (II) (CDS)
Siarczek kadmu jest bardzo nierozpuszczalną sól, która jest natychmiast mieszana w roztworze jonu kadmu (II) z innym, który zawiera jony siarczkowe.
Siarczan miedzi (ii) pentahydrat (cuo4.5h2ALBO)
Podczas rozpuszczania się w wodzie siarczan miedzi (ii) tworzy uwodnione jony intensywnego niebieskiego. Jeśli woda powoli odparowuje, wytrąć piękne niebieskie kryształy cuso4.5h2ALBO. Te kryształy wydają się szlachetne kamienie.
Srebrny bromek (AGBR)
Jest to przykład związku, który wytrąca się bardzo szybko, tworząc osad z bardzo cienkimi cząstkami, które są trudne do filtrowania.
Może ci służyć: równoważna wagaAluminiowy uwodniony tlenek (III) (do2ALBO3.NH2ALBO)
To klasyczny przykład tworzenia galaretowatego osadu. Powstaje, gdy aluminiowy roztwór azotanu (nie (nie3)3).
Siarczek manganu (II) (MNS)
Wiele siarków jest nierozpuszczalnych w wodzie, a siarczk manganu nie jest wyjątkiem. To wytrąca się w postaci bardzo drobnego kurzu.
Chlorek srebra (AGCL)
Jony srebrne (i) tworzą bardzo małe rozpuszczalne sole ze wszystkimi halogenami. Przypadek chlorku srebra jest klasycznym przykładem wytrąconego tworzenia się w laboratorium.
Węglan wapnia (caco3)
Wapń jest jednym z jonów odpowiedzialnych za twardość wody. Gdy woda zawierająca wapń jest podgrzewana, reaguje tworząc węglan wapnia, który wytrąca się w postaci białej warstwy zwanej tatar.
Podwodnik żelaza (III) (wiara2ALBO3.NH2ALBO)
To kolejny przykład galaretowatego osadu, który powstaje w reakcji roztworu zawierającego jony żelaza (III) z wodorotlenkiem sodu lub potasu.
Wodorotlenek magnezu (MG (OH)2)
Magnez jest drugim kationem odpowiedzialnym za twardość wody, ponieważ może wytrącić w postaci wodorotlenku magnezu w rurach i innych systemach ogrzewania wody.
Bibliografia
- Bancoft, w. D. (1918). Zarys chemii koloidów.-Iii. Journal of the Franklin Institute, 185(3), 373-387. https: // doi.Org/10.1016/S0016-0032 (18) 90710-6
- Civan, f. (2007). Wzrost kryształów i tworzenie się skali w porowatych mediach. Uszkodzenie formacji zbiornika, 235-255. https: // doi.Org/10.1016/B978-075067738-7/50010-5
- Skoog, d. DO., West, d. M., Holler, f. J., & Crouch, s. R. (2013). Podstawy chemii analitycznej. Nowy Jork, Nowy Jork: Cengage Learning.
- Współtwórcy Wikipedii. (2021, 10 stycznia). Opady (chemia). Odzyskane z.Wikipedia.org

