Polaryzacja (chemia) Co to jest, definicja, przykłady
- 4117
- 1203
- Bertrand Zawadzki
Czym jest polaryzacja chemiczna?
Polaryzacja chemiczna Jest to właściwość charakteryzująca się obecnością wyraźnego heterogenicznego rozkładu gęstości elektronicznej w cząsteczce. Dlatego w jego strukturze istnieją negatywnie obciążone regiony (δ-), a inne dodatnie naładowane (δ+), generując moment dipolowy.
Moment dipolowy (µ) łącza jest formą ekspresji polaryzacji cząsteczki. Jest zwykle reprezentowany jako wektor, którego pochodzenie znajduje się w obciążeniu (+), a jego koniec znajduje się w obciążeniu (-), chociaż niektóre chemikalia reprezentują go w odwrotnej części.
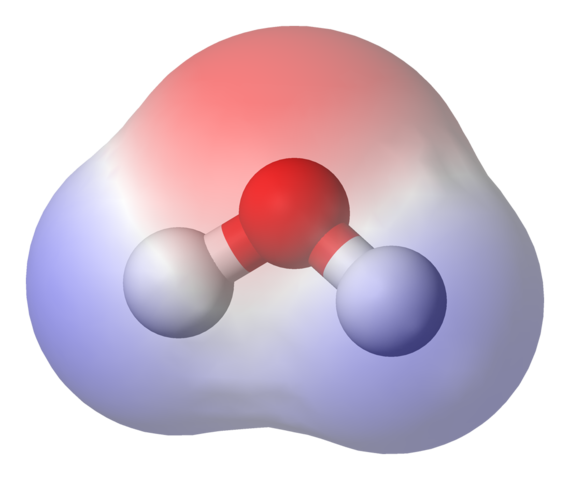
 Mapa potencjału elektrostatycznego dla cząsteczki wody. Źródło: Benjah-BMM27 przez Wikipedia.
Mapa potencjału elektrostatycznego dla cząsteczki wody. Źródło: Benjah-BMM27 przez Wikipedia. Na górnym obrazie pokazano mapę potencjału elektrostatycznego dla wody, h2ALBO. Region czerwonawy (atom tlenu) odpowiada temu o najwyższej gęstości elektronicznej i można również zauważyć, że wyróżnia się on w regionach niebieskich (atomy wodoru).
Ponieważ rozkład wspomnianej gęstości elektronicznej jest heterogeniczny, mówi się, że istnieje pozytywny i ujemny biegun. Dlatego mówimy o „polaryzacji chemicznej i na chwilę dipol.
Moment dipolarny
Moment dipolowy µ jest zdefiniowany przez następujące równanie:
µ = δ ·D
Gdzie δ jest ładunkiem elektrycznym każdego bieguna, dodatnie (+δ) lub ujemne (-δ) i D Jest to odległość między nimi.
Moment dipolowy jest zwykle wyrażany w Debye, reprezentowany przez symbol d. Coulomb · Metro jest równoważne 2 998 · 1029 D.
Wartość momentu dipolowego łącza między dwoma różnymi atomami dotyczy różnicy w elektrowni atomów, które tworzą łącze.
Aby cząsteczka była polarna, nie wystarczy mieć linki polarne w swojej strukturze, ale musi również mieć geometrię asymetryczną; W taki sposób, który uniemożliwia sobie momenty dipolowe.
Może ci służyć: karbondy: elementy, cechy i zastosowaniaAsymetria w cząsteczce wody
Cząsteczka wody ma dwa wiązania O-H. Geometria cząsteczki jest kątowa, to znaczy z formą „V”; Tak więc momenty dipolowe linków nie anulują się, ale suma z nich występuje, wskazując na atom tlenu.
Mapa potencjału elektrostatycznego dla H2Lub odzwierciedl to.
Jeśli obserwuje się cząsteczkę kątową H-O-H, może pojawić się następujące pytanie: czy jest to naprawdę asymetryczne? Jeśli narysowana jest wyobrażona oś, która przecina atom tlenu, cząsteczka zostanie podzielona na dwie równe połówki: H-O | O-H.
Ale tak nie jest, jeśli wyobrażona oś jest pozioma. Gdy ta oś dzieli teraz cząsteczkę na dwie połowy, atom tlenu będzie miał z jednej strony, a z drugiej dwa atomy wodoru.
Właśnie dlatego pozorna symetria H2Lub przestaje istnieć, a zatem rozważana jest asymetryczna cząsteczka.
Cząsteczki polarne
Cząsteczki polarne muszą spełniać szereg cech, takich jak:
-Rozkład ładunków elektrycznych w strukturze molekularnej jest asymetryczny.
-Zazwyczaj są rozpuszczalne w wodzie. Wynika to między cząsteczkami polarnymi, które mogą oddziaływać przez siły dipol-dipolo, gdzie woda charakteryzuje się dużym momentem dipolowym.
Ponadto jego stała dielektryczna jest bardzo wysoka (78,5), co pozwala utrzymać osobne obciążenia elektryczne zwiększające jego rozpuszczalność.
-Zasadniczo cząsteczki polarne mają wysokie punkty wrzenia i fuzji.
Siły te są składane przez interakcję Dipolo-Dipolo, siły dyspersyjne Londynu i tworzenie mostów wodorowych.
Może ci służyć: siarczan żelaza (FESO4): co to jest, struktura, właściwości, synteza-Ze względu na ładunek elektryczny cząsteczki polarne mogą napędzać energię elektryczną.
Przykłady
południowy zachód2
Dwutlenek siarki (więc2). Tlen ma elektroonegatywność 3,44, podczas gdy elektroonegatywność siarki wynosi 2,58. Dlatego tlen jest bardziej elektroonywalny niż siarka. Istnieją dwa łącza s = o, mają obciążenie lub jeden obciążenie i s obciążenie+.
Ponieważ jest to cząsteczka kątowa z S we wierzchołku, dwa momenty dipolowe są zorientowane w tym samym kierunku; I dlatego się sumują, tworząc taką cząsteczkę2 być polarnym.
Chcl3
Chloroform (HCCL3). Istnieje link c-h i trzy linki c-cl.
Elektronialiczność C wynosi 2,55, a elektroonegatywność H wynosi 2,2. Zatem węgiel jest bardziej elektrowni niż wodór; I dlatego moment dipolowy zostanie zorientowany z H (δ+) do C (δ-): Cδ--Hδ+.
W przypadku linków C-CL C ma elektroonywność 2,55, podczas gdy CL ma elektroonegatywność 3,16. Moment dipolowy lub dipolowy jest zorientowany z C do CL w trzech linkach C δ+-Cl δ-.
Gdy istnieje słaby region elektronów, wokół atomu wodoru i region bogaty w elektrony składające się z trzech atomów chloru, CHCL3 Jest uważany za cząsteczkę polarną.
Hf
Fluor wodoru ma tylko jedno wiązanie H-F. Elektroronialiczność H wynosi 2,22, a elektroonegatywność F wynosi 3,98. Dlatego fluor kończy się największą gęstością elektroniczną, a związek między obiema atomami najlepiej opisać: Hδ+-Fδ-.
Może ci służyć: wodorotlenek aluminiowy: struktura, właściwości, zastosowania, ryzykoNH3
Amoniak (NH3) ma trzy linki N-H. Elektroroniacyjność N wynosi 3,06, a elektroonegatywność H wynosi 2,22. W trzech wiązaniach gęstość elektroniczna jest ukierunkowana na azot, jest jeszcze większy przez obecność pary wolnych elektronów.
Cząsteczka NH3 Jest czworościenne, a atom n zajmuje wierzchołek. Trzy momenty dipolowe, odpowiadające linkom N-H, są zorientowane w tym samym kierunku. W nich δ- znajduje się w n, a δ+ w h. Zatem linki to: nδ--Hδ+.
Te momenty dipolowe, asymetria cząsteczki i moment obrotowy azotu bez elektronów sprawiają, że amoniak jest wysoce polarną cząsteczką.
Makromolekuły z heteroátomos
Gdy cząsteczki są bardzo duże, nie jest już dokładne klasyfikowanie ich jako niewielkich lub polarnych. Wynika to z faktu, że mogą istnieć części jego struktury zarówno z charakterystyką apolarną (hydrofobową), takimi jak polarna (hydrofilowa).
Tego rodzaju związki są znane jako amfifilos lub amfipatyczny. Ponieważ część apolarną można uznać za słabą w elektronach w odniesieniu do części polarnej, w strukturze występuje polarność, a związki amfiprylowe są uważane za związki polarne.
Można ogólnie oczekiwać, że makrocząsteczka z heteroatomami ma momenty dipolowe, a wraz z nią polarność chemiczna.
Heteroátomos jest rozumiany przez tych, którzy różnią się od tych, które tworzą szkielet struktury. Na przykład szkielet gazowany jest biologicznie najważniejszy ze wszystkich, a atom, z którym łączy węgiel (oprócz wodoru), nazywa się heteroátomo.
Bibliografia
- Związki polarne i niepolarne. St. Louis Community College. Odzyskane od: użytkowników.STLCC.Edu
- Jak wyjaśnić polaryzację. Naukowe. Odzyskane z: naukowe.com

