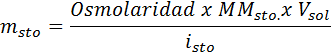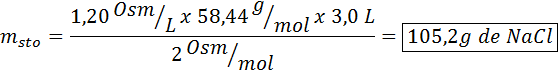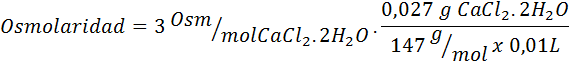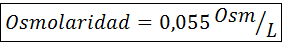Osmolarność
- 4253
- 206
- Herbert Wróblewski
Co to jest osmolowość?
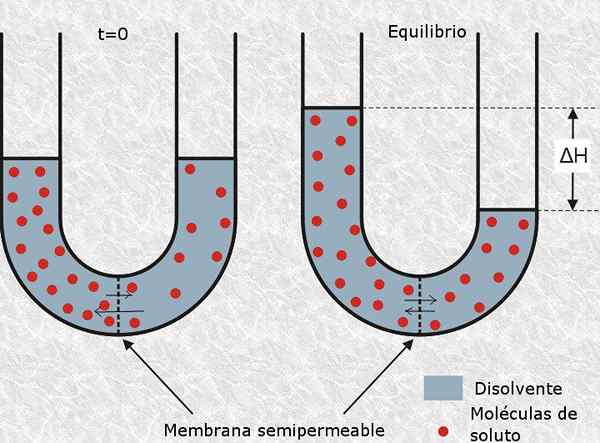
Osmolarność Jest to jednostka stężenia, która wskazuje stężenie molowe zbioru cząstek osmotycznie aktywnych obecnych w roztworze. Innymi słowy, osmolarność jest molowością osmotycznie aktywnych cząstek.
jest zdefiniowany jako Osmotycznie aktywna cząstka do tej neutralnej lub jonowej cząsteczki, która nie może przekroczyć membrany półprzepuszczalnej, takiej jak błona komórkowa. Obecność tego typu cząstek generuje ciśnienie osmotyczne w roztworze, a zatem jej nazwa.
Nazywana jest liczba moli osmotycznie aktywnych Osmole (reprezentowane przez symbol OSM), więc osmolarność jest wyrażana w jednostkach OSM/L.
Znaczenie osmolarności
Osmolarność jest pojęciem o wielkim znaczeniu dla biologii i medycyny, ponieważ równowaga osmotyczna komórek z ich środowiskiem jest niezbędna do ich przetrwania. Na przykład wstrzyknięcie roztworu o bardzo wysokiej lub bardzo niskiej osmolarności dożylnie może z łatwością spowodować śmierć pacjenta.
 Osmolarność jest istotnym aspektem rozwiązań w medycynie i biologii
Osmolarność jest istotnym aspektem rozwiązań w medycynie i biologii Z drugiej strony bardzo powszechna technika, której biolodzy komórkowe stosują do łamania komórek różnych typów, jest liza osmotyczna. Polega to na umieszczeniu komórek w roztworze hipotonicznym (o bardzo niskiej osmolarności), aby woda roztworu penetrowała je przez osmozę i pękła.
To sprawia, że jest to bardzo ważne zarówno dla lekarzy, jak i dla biologów i specjalistów z innych obszarów, wiedząc, mierząc lub wiedząc, jak obliczyć osmolarność roztworu.
Może ci służyć: stężenie procentoweRóżnice między osmolarnością a osmolnością
Mówiąc o osmolarności, należy również mówić o osmoczych. Osmolalność jest podobna do osmolarności, w taki sam sposób, że moralność jest podobna do molowości.
Podczas gdy osmolowość wskazuje Liczba osmoli na litr rozwiązania (OSM/L), Osmolalność wskazuje to samo, ale Na każdy kilogram rozpuszczalnika (OSM/kg).
Osmolalność ma tę zaletę, że nie zależnie od objętości roztworu, ani nie zależy od gęstości ani temperatury. Z tego powodu rozwiązanie będzie miało taką samą osmolalność w temperaturze 25 ° C jak w 37 ° C. Z drugiej strony jego osmolarność 37 ° C będzie nieco niższa niż jej osmolarność w temperaturze 25 ° C, ze względu na wzrost objętości rozszerzalności cieplnej.
Osmolalność jest zwykle łatwiejsza do pomiaru eksperymentalnie niż osmolarność. Jednak osmolarność jest łatwiejsza do obliczenia i jest łatwiejszą jednostką do pracy po przygotowaniu rozcieńczeń.
Jak obliczono osmolarność roztworu?
Istnieje kilka sposobów obliczania osmolarności roztworu, w zależności od policzonych informacji. Można go obliczyć na podstawie:
- Ilości substancji rozpuszczonej i rozwiązania.
- Molowa obecności substancji rozpuszczonych.
- Poszczególne stężenia jonów.
- Procent m/v rozpuszczonych, między innymi.
We wszystkich przypadkach obliczenia oparte są na ogólnej wzorze osmolarności, czyli:

Gdzie NOSM Jest to liczba osmoli obecnych w rozwiązaniu i Vsłońce Jest to objętość tego samego wyrażonego w litrach. Liczba osmoli jest obliczana przez pomnożenie liczby moli w substancji rozpuszczonej przez liczbę cząstek, w których dysocjuje w roztworze.
Może ci służyć: heterogeniczne mieszanki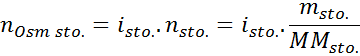
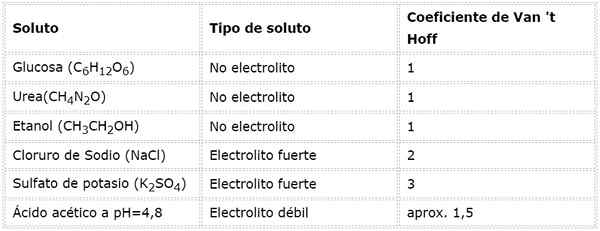
W tym równaniu, NSto Jest to liczba moli substancji rozpuszczonej, MSto to jego masa (w g), MmSto Jest to jego masa molowa (w g/mol) i SiemaSto Jest to współczynnik van 't hoff z substancji rozpuszczonej. Ten współczynnik ma wartość z 1 dla substancji rozpuszczonych nieelektrolitów (Na przykład glukoza).
W przypadku silnych elektrolitów, które są całkowicie zdysocjowane (takie jak chlorek sodu, NaCl) współczynnik Van 'T jest równy całkowitej liczbie jonów, w których każdy kret złożony dysocjuje.
Na przykład w przypadku siarczanu potasu k2południowy zachód4, którego reakcją dysocjacji jest:
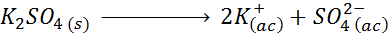
Każdy mol soli, która się rozpuszcza, wytwarza 3 mole jonów (2 k jonów+ I 1 więc jon42-), stąd I = n = 3.
W przypadku słabych elektrolitów obliczenia są bardziej skomplikowane, ale zwykle są one określane eksperymentalnie. Poniższa tabela podsumowuje współczynniki Van 'T Hoff dla niektórych wspólnych substancji rozpuszczonych.
Przykłady obliczania osmolarności
1. Przykład 1
Określ osmolarność przygotowanego roztworu poprzez rozpuszczenie 10 g NaCl i 10 g glukozy w 100 ml roztworu
Rozwiązanie: W takim przypadku osmole każdej substancji rozpuszczonej są obliczane osobno, a następnie dodają. Masy molowe wynoszą odpowiednio 58,45 g/mol i 180 g/mol, a współczynniki Ve 'T wynoszą 2 i 1:
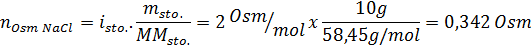
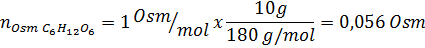
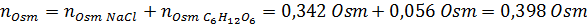
Teraz obliczamy osmolarność za pomocą wzoru, wiedząc, że 100 ml jest równa 0,100L:
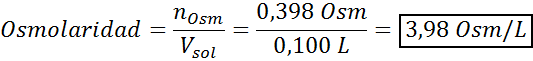
Wreszcie osmolarność roztworu wynosi 3,98 OSM/L.
2. Przykład 2
Określ osmolarność roztworu molowego siarczanu potasu 0,05.
Rozwiązanie: Jeśli znamy już molowość substancji rozpuszczonej, obliczenie osmolarności jest tak proste, jak pomnożenie tego stężenia przez współczynnik Hoffa Van 'T.
Może ci służyć: benzaldehyd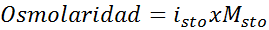
W tym przypadku współczynnik soli to 3.
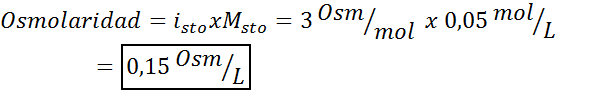
3. Przykład 3
Określ osmolarność próbki w osoczu zawierającej 0,125 M jonów sodu, 0,020 M jonów potasowych i 0,145 jonów chlorkowych.
Rozwiązanie: Osmolarność poszczególnych jonów jest równa ich molowości, ponieważ jony nie dysocjują więcej i mają I = 1. Z tego powodu w tym przypadku konieczne jest tylko pomnożenie I = 1 Każda koncentracja i dodaj:
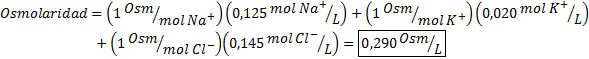
4. Przykład 4
Oblicz osmolarność roztworu zawierającego 27 mg CAP2.2h2Lub na każde 10 ml roztworu
Rozwiązanie: Masa cząsteczkowa Cochla2.2h2Lub to 147 g/mol. Podczas rozpuszczania sól jest podzielona na 2 cząsteczki wody i trzy jony. Jednak cząsteczki wody nie są osmotycznie aktywnymi cząstkami, więc nie są one uwzględnione za obliczenia osmolarności, a współczynnik tego związku wynosi 3.

5. Przykład 5
Jaka masa chlorku sodu jest potrzebna do przygotowania 3 litrów roztworu, którego osmolarność wynosi 1,20 OSM/L?
Rozwiązanie: W takim przypadku, gdy żądana jest masa substancji rozpuszczonej i mamy objętość i stężenie, wystarczy oczyścić masę wzoru osmolarnego.