Struktura chemiczna azotanu baru, stosowanie, właściwości

- 3652
- 335
- Bertrand Zawadzki
On azotan baru Jest to sól złożona z atomu baru (BA) i jonu azotanu (nie3). Jest przedstawiony jako biała krystaliczna substancja stała w temperaturze pokojowej i istnieje w naturze jako bardzo rzadki minerał znany jako Nitrobarita. Jego właściwości sprawiają, że jest to toksyczny związek, którym należy starannie leczyć.
W rzeczywistości ten związek ma wiele zastosowań w przemyśle wojskowym, ponieważ można go powiązać z innymi substancjami chemicznymi i dodawać między innymi z formułami wybuchowymi i zapalającymi, między innymi.
 Wygląd azotanu baru. Źródło: w. Oelen/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)
Wygląd azotanu baru. Źródło: w. Oelen/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) [TOC]
Formuła
Azotan baru, zwany także dyetranem baru, ma wzór chemiczny BA (no3)2, i jest zwykle wytwarzane przez dwie metody.
Pierwszy z nich obejmuje rozpuszczanie małych kawałków węglanu baru (Bachus3) W medium -kwasowym (HNO3, wysoce żrący kwas mineralny), umożliwiając oskarżenie zanieczyszczeń żelaza, a następnie tę mieszaninę jest filtrowana, odparowana i krystalizowana.
Druga metoda odbywa się poprzez połączenie chlorku baru (BACL2, jedna z soli baru o większej rozpuszczalności w wodzie) z rozgrzanym roztworem azotanu sodu. To generuje reakcję, która powoduje rozdzielenie mieszanin kryształów azotanu baru.
Struktura chemiczna azotanu baru
Ta sól ma charakterystykę sześciennej struktury krystalicznej lub bezwodnych okaedrosów.
Jego struktura chemiczna jest następująca:
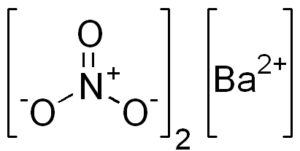
Dysocjacja
W wysokich temperaturach (592 °2) i tlen (lub2), Zgodnie z następującą reakcją chemiczną:
Może ci służyć: wodorotlenek berylowy (be (OH) 2)2BA (nie3)2 + Ciepło → 2bao + 4no2 +ALBO2
W mediach o wysokich stężeniach tlenku azotu (NO) rozkład azotanu baru wytwarza związek zwany azotynem baru (BA (NO2)2), Zgodnie z następującym równaniem:
Łazienka3)2 + 2no → BA (nie2)2 + 22
Reakcje z rozpuszczalnym metalem lub siarczanem kwasu siarkowego (H2południowy zachód4) Generuj siarczan baru (Baso4). Zdecydowana większość nierozpuszczalnych soli barowych, takich jak węglan (Bachus3), Szczawian (BAC2ALBO4) lub fosforan metalowy (BA3(PO4)2), są wytrącane przez podobne reakcje podwójnego rozkładu.
Zastosowanie azotanu baru
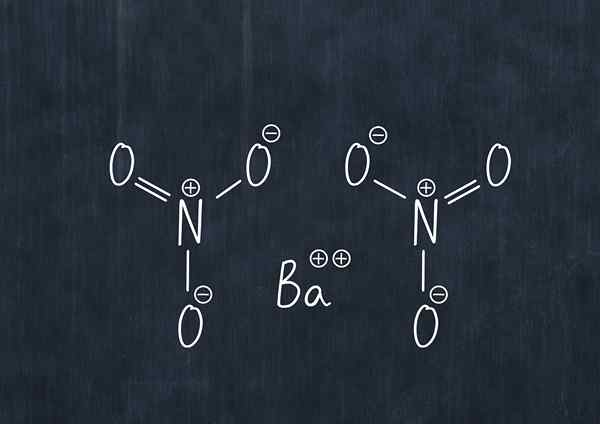 Chemiczny wzór azotanu baru
Chemiczny wzór azotanu baru Ta substancja w pyle jest środkiem utleniającym i reaguje znacząco na wspólne środki redukujące.
Gdy sól ta jest mieszana z innymi metaliami, takimi jak glin lub cynk w drobno podzielonych kształtach lub ze stopami, takimi jak glin-magn0esio, włącza się i wykorzystuje uderzenie. Z tego powodu azotan baru jest uważany za doskonały element broni wojskowej i materiałów wybuchowych.
Wraz z trinitrotoluenem (znanym na rynku jako TNT, lub C6H2(NIE2)3Ch3) oraz spoiwo (regularnie wosk parafinowy), sól tworzy związek zwany baratol, który ma właściwości wybuchowe. Wysoka gęstość azotanu baru powoduje, że baratol również nabiera większą gęstość, co czyni go bardziej skutecznym w swojej funkcji.
Azotan barowy łączy również pył aluminiowy, wzór, który powoduje tworzenie migającego prochu, który jest używany głównie w fajerwerkach i pirotechnikach teatralnych.
To błyski widziały również zastosowania w produkcji rozbłysków (takich jak miary antimile samolotów) i w oszołomionych granatach. Ponadto ta substancja jest wysoce wybuchowa.
Może ci służyć: cyjanku sodu (nacn): struktura, właściwości, ryzyko, zastosowaniaTa sól jest łączona z mieszaniną reagującą zwaną termitem, aby utworzyć zmianę tego, tak zwanego terminu, który przez krótki czas generuje krótkie i bardzo mocne błyski o wysokich temperaturach w małych obszarach.
Termin-th3 jest terminem, który zawiera skład 29 % przez azotan barowy, który pomaga zwiększyć efekt termiczny, generować płomienie i znacznie zmniejszyć temperaturę zapłonu terminu.
Theroots są zwykle stosowane w produkcji granatów zapalających i funkcjonują niszczenie wojskowego pancerza i konstrukcji.
Ponadto azotan baru był jednym z najczęściej używanych składników w produkcji zarzutów zapalających używanych przez Brytyjczyków w ich samolotach wojennych podczas II wojny światowej, które uzbrojone w amunicję zapalającą, która służyła do zniszczenia samolotów wroga.
Wreszcie, ta sól stosuje w procesie produkcyjnym tlenku baru, w branży zastawek termionicznych i, jak już powiedziano, w tworzeniu pirotechniki, zwłaszcza tych z zielonych kolorów.
Fizyczne i chemiczne właściwości
 Bario Bai Nitrato (NO3) 2
Bario Bai Nitrato (NO3) 2 Sól jest prezentowana jako biała, higroskopijna i stała toaletowa, która jest mało rozpuszczalna w wodzie i całkowicie nierozpuszczalna w alkoholi.
Ma masę molową 261 337 g/mol, gęstość 3,24 g/cm3 i punkt fuzji 592 ° C. Po osiągnięciu temperatury wrzenia się rozpada się, jak powiedziano powyżej. W temperaturze pokojowej ma rozpuszczalność w wodzie 10,5 g/100 ml.
Jest uważany za stabilny, ale jest silnym środkiem utleniającym i musi być z dala od materiałów palnych, aby uniknąć pożaru. Ma wrażliwość na wodę i nie powinien być mieszany z kwasami lub bezwodnymi.
Może ci służyć: izotermy adsorpcyjne: koncepcja, typy, przykładyW wysokich stężeniach (na przykład pojemniki) muszą być izolowane z substancji, które mogą sprawić, że reaguje, ponieważ może gwałtownie wykorzystać.
Jak każdy inny rozpuszczalny związek baru, jest to toksyczna substancja dla zwierząt i ludzi.
Nie należy go wdychać ani spożywać, ponieważ objawy zatrucia (zwłaszcza utwardzanie mięśni twarzy), wymioty, biegunki, ból brzucha, drżenie mięśni, lęk, osłabienie, niewydolność oddechowa, nieregularność serca oraz napadu i konfiskaty.
Śmierć może nastąpić po zatruciu tej substancji, kilka godzin lub kilka dni po przedstawieniu.
Wdychanie azotanu baru generuje podrażnienie w błonie śluzowej oddechowej, aw obu trybach zatrucia roztwory soli siarczanowych należy przygotować do zastosowania pierwszej pomocy dla dotkniętej dotkniętej.
W przypadku wycieków należy go odizolować z palne substancje i materiały, aw przypadkach pożaru nigdy nie należy się kontaktować z suchymi chemikaliami lub piankami. Obszar musi być zalany wodą, jeśli pożar jest większy.
Bibliografia
- Mabus. (S.F.). Nauk. Uzyskane z Sciencemadness.org
- Bomba Insenrza Stanów Zjednoczonych TH3-M50A3. (S.F.). Uzyskane z amunicji.com
- Cameo Chemicals. (S.F.). Uzyskane z Cameochemicals.Noaa.Gov
- Chemspider. (S.F.). Uzyskane od Chemspider.com

