Bradford Method Co to, zasada, odczynniki, używa

- 4183
- 179
- Matylda Duda
On Metoda Bradford Jest to metoda kolorymetryczna stosowana obecnie do szybkiego oszacowania całkowitego stężenia białka w próbkach eksperymentów biologicznych. Jest stosowany w wielu dziedzinach badań biologicznych, medycznych, weterynaryjnych, agronomicznych itp.
Jest znany jako „Metoda Bradford”, ponieważ została po raz pierwszy opisana przez Marion Bradford w 1976 r. W swojej publikacji zatytułowanej Szybka i wrażliwa metoda kwantyfikacji białek w ilości mikrogramów z wykorzystaniem zasady unia białka-jouth.
 Zdjęcie płytki ELISA, w której próbki przygotowały się do kwantyfikacji Bradford (źródło: Helito, CC BY-SA 4.0, Via Wikimedia Commons)
Zdjęcie płytki ELISA, w której próbki przygotowały się do kwantyfikacji Bradford (źródło: Helito, CC BY-SA 4.0, Via Wikimedia Commons) Od czasu jej propozycji metoda ta była popularnie spopularyzowana, ponieważ jest rozpoznawana bardziej wrażliwa niż inne metody kwantyfikacji białka (takie jak Lowry i Biuret, na przykład); bardziej stabilna złożona forma i jest ekonomiczna i łatwa do wykonania.
Ponadto wykazano, że stosowane przez nich odczynniki mają bardzo niewielką interferencję w pomiarach spektrofotometrycznych w różnych warunkach.
[TOC]
Zasada metody
Metoda Bradforda opiera się na kwantyfikacji zmian kolorów w roztworze ze względu na związek - w warunkach kwaśnych - cząsteczek białka próbki z cząsteczkami specjalnego barwnika: Coomassie Blue Genialny niebieski G250.
Gdy ten barwnik jest dodawany do roztworu białkowego, wiąże się on z tymi cząsteczkami przez siły elektrostatyczne, a ta reakcja jest dowodowa jako czerwonawo -brązowa zmiana koloru na niebieski na niebieski.
Białka i aminokwasy
Podobnie jak ciało powstaje przez wiele komórek i kwasów nukleinowych (takich jak DNA i RNA) powstają przez nukleotydy, białka powstają przez uporządkowane sekwencje niektórych cząsteczek zwanych aminokwasami.
Aminokwas to cząsteczka złożona z centralnego atomu węgla, do którego połączono 4 różne grupy chemiczne: atom wodoru, grupa karboksylowa, grupa aminowa i grupa lub łańcuch boczny, co daje tożsamość.
Istnieje 20 aminokwasów, które są wspólne dla wszystkich białek, które różnią się od siebie w odniesieniu do właściwości ich grup pobocznych: istnieją podstawowe aminokwasy, kwasy, polarne, apolowe, cykliczne, aromatyczne itp.
Może ci służyć: prawo tolerancji Shelford: co to jest i przykładySuma charakterystyk tych aminokwasów i kolejności, w której łączą się, tworząc strukturę białka, nadaje każdemu białkowi serię konkretnych cech fizykochemicznych, czy to w odniesieniu do ich obciążenia, masy, hydrofobowości, między innymi.
Kompleks odcienia białka
Metoda Bradforda kwantyfikuje obecność reszt aminokwasowych o podstawowych cechach w próbkach biologicznych, szczególnie aminokwasach, takich jak arginina, lizyna i histydyna, które są łatwiejsze za pomocą Coomassie Blue.
Zmiany kolorów są określane ilościowo jako zmiany w absorbancji próbek, które są mierzone za pomocą spektrofotometru dostosowanego do długości fali 595 nm.
Co to jest absorbancja?
Jest również znany jako gęstość optyczna i określa ilość światła pochłanianego przez roztwór. Ta absorpcja zależy od długości fali światła stosowanego do napromieniowania roztworu, ponieważ nie wszystkie cząsteczki są w stanie wchłonąć tę samą długość fali.
Zjawisko to zostało podsumowane w prawie znanym jako prawo piwa-lamberta, które ustanawia związek między spadkiem ilości światła, który przechodzi przez substancję a właściwościami wspomnianej substancji.
Na przykład, gdy światło jest przenoszone przez roztwór, istnieją dwie pomiary intensywności: intensywność padania (przed przekroczeniem roztworu) i przenoszona intensywność (ogólnie niższa, która odpowiada ułamkowi światła, które nie zostało wchłonięte przez roztwór).
Związek między obiema wartościami jest taki, który jest znany jako przetwarzanie i ma wartości między 0 a 1 lub jest wyrażany w punkcie procentowym.
Absorbancja jest związana z przetwarzaniem logarytmicznego sposobu, a prawo piwa-Lamberta proponuje liniową zależność między absorbancją roztworu a jego stężeniem, jego współczynnikiem wymierania molowego i współczynnikiem optycznym roztworu; Równanie matematyczne opisujące to prawo jest następujące:
Może ci służyć: szkodliwa fauna: przyczyny proliferacji, konsekwencje, kontrolaA (absorbancja) = ε (współczynnik ekstynkcji molowej) C (stężenie) L (długość przepustki światła)
Stężenie roztworu jest obliczane przez wyczyszczenie wspomnianego nieznanego równania i wykonanie odpowiednich obliczeń (C = A/εL)
Co to jest spektrofotometr?
Jest to urządzenie używane do kwantyfikacji ilości światła (w zależności od długości fali), które pochłania cząsteczki w roztworze lub, innymi słowy, ilość, które mijają.
Spektrofotometry działają, emitując wiązkę światła (widoczne lub ultrafioletowe), która przechodzi przez pryzmat (lub urządzenie znane jako Monochromator sieci dyfrakcyjnej), który rozkłada go w różnych długościach fali, które to tworzą, umożliwiając „wybrać” określoną długość.
Światło to jest przepuszczane przez specjalną rurkę, która zawiera analizowaną próbkę, a następnie dociera do detektora, który postrzega ilość światła przenoszonego ze wspomnianej próbki (które nie zostało wchłonięte), które można zaobserwować później dzięki „tłumaczowi”. ma interfejs graficzny.
Dye: Coomassie Blue Genialny niebieski G 250
Najważniejszym odczynnikiem tej metody jest bez wątpienia barwnik użyty do „oznaczenia” białek w próbce. Bradford zaproponował swoją pracę, ponieważ ten barwnik istnieje na dwa sposoby: jeden czerwony i jeden niebieski. Czerwony kształt staje się niebieskim kształtem, gdy barwnik wiąże się z białkiem, tworząc kompleks.
Kompleks niebieski białko-białko ma bardzo wysoki współczynnik ekstynkcji molowej, co powoduje większą wrażliwość na kwantyfikację stężenia białka w analizowanych próbkach.
Odczynniki
Chociaż rozwiązanie zastosowane w tej metodzie kwantyfikacji jest ogólnie sprzedawane w zamkniętych pojemnikach, już przygotowane -„Bradford reaktywne” -, główne stosowane odczynniki to:
- Coomassie Blue Genialny niebieski G50 (0.01% w/v)
- Kwas fosforowy (8.5 % w/v)
- Etanol (4.7% w/v)
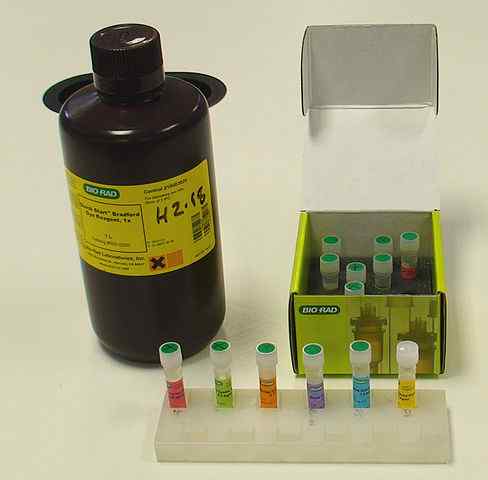 Zestaw kwantyfikacji białek metodą Bradforda (źródło: Vivo Rolfe, CC BY-SA 4.0, Via Wikimedia Commons)
Zestaw kwantyfikacji białek metodą Bradforda (źródło: Vivo Rolfe, CC BY-SA 4.0, Via Wikimedia Commons) Jak w dowolnej metodzie i protokołu kwantyfikacji białka metodami spektrofotometrycznymi, konieczne jest posiadanie białka „standardowego” lub „standardowego” w celu wykonania krzywa kalibracji określić wartości absorbancji związane z różnymi stężeniami białka; ogólnie stosuje się albuminę surowicy bydlęcej.
Może ci podać: czekoladowy agarMetoda polega na zmieszaniu niektórych objętości próbek problem z pewnymi tomami odczynnika Bradforda; Poczekaj kilka minut na interakcję barwnika i zmiany koloru, a następnie zmierzono i zapisz wartości absorbancji, aby wykonać kolejne obliczenia.
Używa/aplikacje
Metoda Bradforda jest jedną z metod kwantyfikacyjnych lub oszacowania najczęściej stosowanego stężenia białka na świecie, głównie ze względu na jego niski koszt, z prędkością, z jaką uzyskuje się wyniki, do dużej stabilności między białkiem a barwnikiem, aby zastosować się jego odtwarzalność i minimalna zakłócenia, jakie mają elementy odczynników zastosowanych podczas pomiaru.
Metoda jest stosowana w setkach różnych zastosowań naukowych do oznaczania białek w różnych kontekstach: fizjologiczne, cytologiczne, immunologiczne, kliniczne, przemysłowe (szczególnie w przemyśle spożywczym) itp.
Eksperymentalnie ta metoda jest bardzo przydatna dla:
- Monitoruj ilość białka zawartego w objętościach, które są stopniowo uzyskiwane z kolumny chromatograficznej (w kolumnach powinowactwa, wymiana jonów, absorpcja, filtracja żelowa, między innymi).I. Przeanalizuj ułamki protokołów oczyszczania białka.
- Monitoruj ilość białka obciążonego żelem do elektroforezy.
- Oszacuj ilość białka uzyskanego w układzie nadekspresji.
Bibliografia
- Bonjoch, n. P., & Tamayo, p. R. (2001). Ocena ilościowa zawartości białka metodą Bradforda. W podręczniku technik ekologii roślin (PP. 283-295). Springer, Dordrecht.
- Bradford, m. M. (1976). Szybka i wrażliwa metoda ilościowa ilości mikrogramów białka przy użyciu wiązania głównego dnia białka. Biochemia analityczna, 72 (1-2), 248-254.
- Kielkopf, c. L., Bauer, w., & Urbatsch, ja. L. (2020). Test Bradforda do określania stężenia białka. Protokoły Cold Spring Harbor, 2020 (4), PDB-Prot102269.
- Sapan, c. V., Lundblad, r. L., & Price, n. C. (1999). Kolorymetryczne techniki testu białka. Biotechnologia i biochemia stosowana, 29 (2), 99-108.
- Walker, J. M. (Ed.). (1996). Podręcznik protokołów białkowych (vol. 1996). Springer Science & Business Media.

