Redox Bilans Metoda, przykłady, ćwiczenia
- 726
- 16
- Herbert Wróblewski
On Metoda równoważenia redoks Pozwala zrównoważyć równania chemiczne reakcji redoks, które w przeciwnym razie byłyby bólem głowy. Tutaj jeden lub więcej gatunków wymiany elektronów; Ten, który je przekazuje lub traci, nazywa się gatunkami utleniającymi, podczas gdy ten, który je akceptuje lub wygrywa, gatunek redukcyjny.
W tej metodzie konieczne jest znanie liczby utleniania tych gatunków, ponieważ ujawniają, ile elektronów zyskało lub zgubiło się przez mol. Dzięki temu można zrównoważyć ładunki elektryczne, pisząc w równaniach elektrony, jakby były reagentami lub produktami.
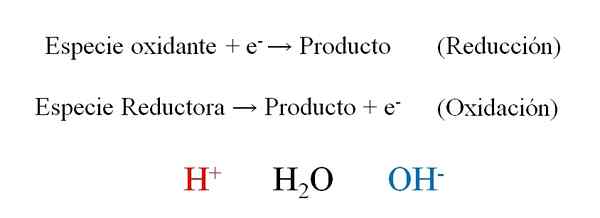
 Ogólne półki reakcji redoks z trzema bohaterami podczas ich równoważenia: H+, H2O i OH-. Źródło: Gabriel Bolívar.
Ogólne półki reakcji redoks z trzema bohaterami podczas ich równoważenia: H+, H2O i OH-. Źródło: Gabriel Bolívar. Najwyższy obraz pokazuje, w jaki sposób elektrony skutecznie i- Są one umieszczane jako odczynniki, gdy gatunek utleniający je wygrywa; I jako produkty, gdy gatunki redukujące je traci. Zauważ, że aby zrównoważyć tego rodzaju równania, konieczne jest opanowanie pojęć liczby utleniania i utleniania.
Gatunek h+, H2Lub i och-, W zależności od pH pożywki reakcyjnej umożliwia równoważenie redoks, więc bardzo często można je znaleźć w ćwiczeniach. Jeśli podłoże jest kwasem, zwracamy się do H+; Ale jeśli wręcz przeciwnie, medium jest podstawowe, używamy OH- Do równoważenia.
Natura samej reakcji decyduje o tym, jakie powinno być pH medium. Dlatego, chociaż można go zrównoważyć, zakładając kwas lub podstawowe pożywkę, końcowe równanie zrównoważone wskazuje, czy jony h są nieprawdopodobne+ I och-.
[TOC]
Kroki
- Ogólny
Sprawdź liczby utleniania odczynników i produktów
Załóżmy, że następujące równanie chemiczne:
Cu (y) + agno3(AC) → Cu (nie3)2 + AG (S)
Odpowiada to reakcji redoks, w której następuje zmiana liczby utleniania odczynników:
Cu0(s) + ag+NIE3(AC) → Cu2+(NIE3)2 + AG (S)0
Zidentyfikuj gatunki utleniające i redukcyjne
Gatunki utleniające zyskuje elektrony utleniające gatunki redukujące. Dlatego jego liczba utleniania maleje: staje się mniej dodatnia. Tymczasem wzrasta liczba utleniania gatunków redukujących, ponieważ traci elektrony: staje się bardziej dodatnia.
Zatem w poprzedniej reakcji miedź jest utleniona, ponieważ przechodzi z Cu0 do Cu2+; A srebro jest zmniejszone, ponieważ wychodzi z AG+ Ag0. Miedź to gatunki redukujące i srebrne gatunki utleniające.
Napisz pół -reakcje i równoważenie atomów i obciążeń
Określając, które gatunki zyskują lub tracą elektrony, reakcje redoks są zapisane zarówno dla reakcji redukcji, jak i utleniania:
Cu0 → Cu2+
Ag+ → Ag0
Miedź traci dwa elektrony, a srebrne wygrywa jeden. Umieszczamy elektrony w obu pół -reakcjach:
Może ci służyć: fosforan potasu (K3PO4): Struktura, właściwości, zastosowaniaCu0 → Cu2+ + 2e-
Ag+ + I- → Ag0
Należy zauważyć, że obciążenia pozostają zrównoważone w obu pół -reakcjach; Ale gdyby zostały dodane, prawo ochrony materii zostanie naruszone: liczba elektronów musi być taka sama w dwóch półprzedażach. Dlatego drugie równanie jest mnożone przez 2 i dodaje się dwa równania:
(Cu0 → Cu2+ + 2e-) x 1
(Ag+ + I- → Ag0) x 2
Cu0 + 2ag+ + 2e- → Cu2+ + 2ag0 + 2e-
Elektrony są anulowane za bycie po bokach odczynników i produktów:
Cu0 + 2ag+ → Cu2+ + 2ag0
To jest globalne równanie jonowe.
Zastąpić współczynniki równania jonowego w równaniu ogólnym
Wreszcie współczynniki stechiometryczne poprzedniego równania przenoszą się do pierwszego równania:
Cu (y) + 2agno3(AC) → Cu (nie3)2 + 2ag (s)
Zauważ, że 2 był ustawiony z Agno3 Ponieważ w tej soli srebro jest jak AG+, I to samo dotyczy Cu (nie3)2. Jeśli to równanie nie jest zrównoważone na końcu, wynik jest dokonywany.
Równanie zaproponowane w poprzednich krokach mogło zostać zrównoważone bezpośrednio przez Tanteo. Istnieją jednak reakcje redoks, które potrzebują kwaśnej pożywki (h+) lub podstawowe (och-). Kiedy tak się dzieje, nie można zrównoważyć, zakładając, że medium jest neutralne; Jak właśnie zostało wyświetlone (nie było dodane ani h+ I albo och-).
Z drugiej strony wygodnie jest wiedzieć, że pół -reakcje zapisały atomy, jony lub związki (głównie tlenki), w których występują zmiany liczby utleniania. Zostanie to podkreślone w sekcji ćwiczeń.
- Bilansowanie w kwaśnej pożywce
Gdy pożywka jest kwasem, musisz zatrzymać się na dwóch częściach reakcji. Tym razem w momencie równowagi ignorujemy atomy tlenu i wodoru, a także elektrony. Elektrony będą równoważone na końcu.
Następnie, po stronie reakcji z mniejszymi atomami tlenu, dodajemy cząsteczki wody, aby to zrekompensować. Z drugiej strony równoważymy hydrogeny z jonami H+. I na koniec dodajemy elektrony i postępujemy zgodnie z ogólnymi już odsłoniętymi krokami.
- Bilansowanie w podstawowym medium
Gdy medium jest podstawowe, jest tak samo, jak w środowisku kwaśnym z niewielką różnicą: tym razem z boku, w którym znajduje się więcej tlenu, zostaną zlokalizowane cząsteczki wody równe nadmiarowi tlenu; A po drugiej stronie, OH Jony- Aby zrekompensować hydrogeny.
Wreszcie, bilans elektronów, dodaje się dwie półki, a współczynniki globalnego równania jonowego w równaniu ogólnym są zastąpione.
Może ci służyć: rozproszone systemy: typy, cechy i przykładyPrzykłady
Poniższe równania redoks bez równowagi i zrównoważone służą jako przykłady obserwowania, ile zmiany po zastosowaniu tej metody równoważenia:
P4 + Clo- → PO43- + Cl- (bez równowagi)
P4 + 10 Clo- + 6 godz2O → 4 PO43- + 10 Cl- + 12 godzin+ (Zrównoważony pół kwasu)
P4 + 10 Clo- + 12 Oh- → 4 PO43- + 10 Cl- + 6 godz2O (podstawowy średnie zrównoważone)
Siema2 + Kno3 → i- + Kio3 + NIE3- (bez równowagi)
3i2 + Kno3 + 3H2O → 5i- + Kio3 + NIE3- + 6h+ (Zrównoważony pół kwasu)
Cr2ALBO27- + Hno2 → Cr3+ + NIE3- (bez równowagi)
3hno2 + 5h+ + Cr2ALBO27- → 3no3- +2cr3+ + 4h2O (zrównoważona równowaga kwasu)
Ćwiczenia
Ćwiczenie 1
Zrównoważyć następujące równanie w podstawowym medium:
Siema2 + Kno3 → i- + Kio3 + NIE3-
Kroki ogólne
Zaczynamy od napisania liczby utleniania gatunku, które podejrzewamy, że mają zardzewiałe lub zmniejszone; W tym przypadku atomy jodu:
Siema20 + Kno3 → i- + Ki5+ALBO3 + NIE3-
Zauważ, że jod utlenia się, a jednocześnie jest zmniejszony, dlatego przystępujemy do pisania dwóch odpowiednich reakcji:
Siema2 → i- (Redukcja, dla każdego i- 1 elektron jest zużyty)
Siema2 → IO3- (Utlenianie, dla każdego IO3- 5 elektronów jest uwalnianych)
W pół -utlenianiu umieszczamy anion io3-, i nie do atomu jodu jak ja5+. Zrównoważymy atomy jodu:
Siema2 → 2i-
Siema2 → 23-
Bilansowanie w podstawowym medium
Teraz koncentrujemy się na huśtaniu się w podłożu podstawowym. Półprzewodnik utleniania, ponieważ ma on gatunek natleniony. Dodajemy po stronie produktów taką samą liczbę cząsteczek wody, jak atomy tlenu:
Siema2 → 23- + 6h2ALBO
A po lewej stronie zrównoważymy hydrogeny z OH-:
Siema2 + 12oh- → 23- + 6h2ALBO
Piszemy dwie reakcje pół -reakcyjne i dodajemy brakujące elektrony, aby zrównoważyć obciążenia ujemne:
Siema2 + 2e- → 2i-
Siema2 + 12oh- → 23- + 6h2O + 10e-
Dopasowaliśmy oba liczby elektronów w obu pół -reakcjach i dodaliśmy je:
(SIEMA2 + 2e- → 2i-) x 10
(SIEMA2 + 12oh- → 23- + 6h2O + 10e-) x 2
12i2 + 24 Oh- + 20e- → 20i- + 43- + 12h2O + 20e-
Elektrony są anulowane i podzielone wszystkie współczynniki przez cztery, aby uprościć globalne równanie jonowe:
(12i2 + 24 Oh- → 20i- + 43- + 12h2O) x ¼
3i2 + 6oh- → 5i- + Io3- + 3H2ALBO
I na koniec zastępujemy współczynniki równania jonowego w pierwszym równaniu:
3i2 + 6oh- + Kno3 → 5i- + Kio3 + NIE3- + 3H2ALBO
Może ci służyć: siła jonowa: jednostki, jak to obliczyć, przykładyRównanie jest już zrównoważone. Porównaj ten wynik z równoważeniem w kwaśnej pożywce przykładu 2.
Ćwiczenie 2
Zrównoważyć następujące równanie w pożywce kwaśnej:
Wiara2ALBO3 + Co → Fe + CO2
Kroki ogólne
Obserwujemy liczbę utleniania żelaza i węgla, aby wiedzieć, który z nich utlenił się lub zmniejszył:
Wiara23+ALBO3 + C2+O → Wiara0 + C4+ALBO2
Żelazo zostało zmniejszone, więc jest to gatunek utleniający. Tymczasem węgiel ma zardzewiały, zachowując się jak gatunki redukujące. Półprzewodnikowe reakcje na utlenianie i zwrócenie reakcji to:
Wiara23+ALBO3 → Wiara0 (Redukcja, dla każdej wiary 3 elektrony są spożywane)
CO → CO2 (Utlenianie, dla każdego CO2 2 elektrony są uwalniane)
Zauważ, że piszemy tlenek, wiara2ALBO3, Ponieważ zawiera wiarę3+, Zamiast po prostu przekazywać wiarę3+. Zrównoważymy potrzebne atomy, z wyjątkiem tlenu:
Wiara2ALBO3 → 2Fe
CO → CO2
A równoważenie odbywa się w kwasie w obu częściach reakcji, ponieważ pomiędzy nimi istnieją gatunki natlenione.
Bilansowanie w kwaśnej pożywce
Dodajemy wodę, aby zrównoważyć tlen, a następnie h+ Aby zrównoważyć hydrogeny:
Wiara2ALBO3 → 2Fe + 3H2ALBO
6h+ + Wiara2ALBO3 → 2Fe + 3H2ALBO
Co + h2O → co2
Co + h2O → co2 + 2h+
Teraz równoważymy obciążenia, umieszczając elektrony zaangażowane w reakcje pół -reakcyjne:
6h+ + 6e- + Wiara2ALBO3 → 2Fe + 3H2ALBO
Co + h2O → co2 + 2h+ + 2e-
Dopasowujemy liczbę elektronów w obu pół -reakcjach i dodajemy je:
(6h+ + 6e- + Wiara2ALBO3 → 2Fe + 3H2O) x 2
(CO + H2O → co2 + 2h+ + 2e-) x 6
12 godzin+ + 12e- + 2fe2ALBO3 + 6CO + 6H2O → 4fe + 6h2O + 6co2 + 12h+ + 12e-
Anulujemy elektrony, jony H+ I cząsteczki wody:
2fe2ALBO3 + 6co → 4fe +6co2
Ale te współczynniki można podzielić przez dwa, aby jeszcze bardziej uprościć równanie, mając:
Wiara2ALBO3 + 3CO → 2fe +3co2
To pytanie powstaje: Równoważenie redoks dla tego równania było konieczne? Przez tanteo byłoby znacznie szybsze. To pokazuje, że reakcja ta przebiega zamiennie z średniego pH.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Helmestine, Anne Marie, pH.D. (22 września 2019). Jak zrównoważyć reakcje redoks. Odzyskane z: Thoughtco.com
- Ann Nguyen i Luvleen Brar. (5 czerwca 2019). Równoważenie reakcji redoks. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Quimitube. (2012). Ćwiczenie 19: Dostosowanie reakcji redoks w pożywce podstawowej z dwoma półprzewodnikami utleniania. Odzyskane z: QuimiTube.com
- Washington University w St. Louis. (S.F.). Problemy ćwiczą: reakcje redoks. Odzyskane z: chemii.Wustl.Edu
- John Wiley & Sons. (2020). Jak zrównoważyć równania redoks. Odzyskane z: manekinów.com
- Rubén Darío lub. G. (2015). Równoważenie równań chemicznych. Odzyskane od: Ucz się w linii.Ty.Edu.współ

