Metoda równoważenia algebraicznego (z przykładami)

- 2482
- 701
- Matylda Duda
On Metoda bilansu algebraicznego Jest stosowany w chemii w celu dopasowania liczby atomów po obu stronach reakcji chemicznej. Reakcja chemiczna napisana prawidłowo, musi mieć wzory wszystkich odczynników uczestniczących po lewej stronie i produkty, również z ich wzorami, po prawej stronie.
Jednak gdy masz reakcję, liczba atomów w formułach odczynników jest równa liczbie odpowiednich atomów w formułach produktów.
 Rysunek 1. Metoda równoważenia algebraicznego jest prostym narzędziem do równoważenia równań chemicznych. Źródło: f. Zapata.
Rysunek 1. Metoda równoważenia algebraicznego jest prostym narzędziem do równoważenia równań chemicznych. Źródło: f. Zapata. Jednak ciasto jest zachowane. Na przykład zobaczmy następującą reakcję:
Kcl3 → Kcl + o2
To równanie ma związek zwany chloranem potasu, który jest rozkładany przez ogrzewanie w chlorku potasu i tlenu gazowym. Ale podczas uważnego obserwowania zauważamy, że w cząsteczce chloranu znajdują się 3 atomy tlenu, a po prawej stronie jest tylko jedna cząsteczka tlenu z 2 atomami.
To, co jest wtedy zrobione, to pomnożyć współczynnik numeryczny do odczynnika lewicy, tak że liczba atomów wszystkich uczestniczących pierwiastków była taka sama przed i po reakcji.
Ale ... jaka jest wartość tego współczynnika?
[TOC]
Sposoby równoważenia równań
W poprzednim równaniu łatwo jest określić odpowiednie współczynniki poprzez kontrolę. Jeśli pomnożymy przez 2 po lewej stronie, mamy 2 atomy K, 2 Cl i 6 O.
Dlatego po prawej rozmnażamy chlorek potasu przez 2 i O2 do 3:
2 kclo3 → 2KCl + 3o2
A teraz widzimy, że rachunkowość jest poprawna po obu stronach strzałki, a reakcja była zrównoważona. Należy zauważyć, że inne wartości numeryczne mogą również skutkować równanie zrównoważone, na przykład:
Może ci służyć: kwas borowy: struktura chemiczna, właściwości, przygotowanie, zastosowania4 kclo3 → 4kcl + 6o2
Jednak zawsze należy szukać zestawu całej minimalnej liczby, które równe ilości atomów po obu stronach.
Liczby, które mnożą się każda formuła, są wywoływane współczynniki. Bardzo ważne jest, aby zauważyć, że współczynniki można przypisać do równowagi, ale indeksy dolne muszą pozostać tak, jak pojawiają się w każdej formule.
Współczynniki nie można również wstawić w środku wzoru każdego związku, ponieważ to by to zmieniło.
Proste równania, takie jak przykład, można zrównoważyć przez inspekcję lub wynik. Dla tych, którzy są nieco bardziej złożone, istnieje metoda algebraiczna z serią prostych kroków i podstawowych operacji arytmetycznych szczegółowo opisanych poniżej.
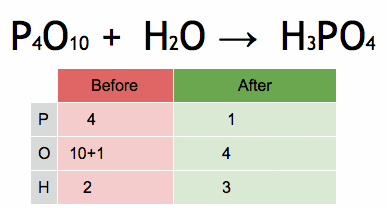 Rysunek 2. Animacja, która pokazuje równowagę równania chemicznego w celu uzyskania kwasu fosforowego. Źródło: Wikimedia Commons. Ephert/cc by-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0)
Rysunek 2. Animacja, która pokazuje równowagę równania chemicznego w celu uzyskania kwasu fosforowego. Źródło: Wikimedia Commons. Ephert/cc by-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0) Kroki w celu zrównoważenia algebracyjnego równania chemicznego
Krok 1
-Przypisać do każdej cząsteczki dowolny współczynnik, symbolizowany przez literę. Tekst A, B, C, D .. ., W razie potrzeby.
Ważny: Przypomnijmy, że tylko współczynnik jest używany przez cząsteczkę i nigdy nie jest przeplatany na jej środku, zawsze jest umieszczony w lewo.
Krok 2
-Zrób listę każdego uczestniczącego elementu.
Krok 3
-Umieść współczynnik lub współczynniki przypisane do każdego związku w lewo i dopasuj te po prawej stronie. Jeśli istnieją indeksy dolne, mnożą się przez współczynnik, aby znaleźć całkowitą liczbę atomów.
A jeśli jakikolwiek element zostanie znaleziony w więcej niż jednej cząsteczce, dodano ilości atomów obecnych z każdej strony. W ten sposób równania częściowe każdego elementu.
Krok 4
-Wartość numeryczna jest przypisywana do jednego ze współczynników. Zwykle ta wartość liczbowa wynosi 1 i jest przypisana do litery, która pojawia się więcej razy. To osiąga proste równanie, które służy jako punkt wyjścia do znalezienia innych współczynników.
Może ci służyć: współczynnik rozcieńczeniaKrok 5
-Określić wartość następującego współczynnika przez prostą arytmetykę i zastąp jego wartość w innym równaniu, aby podnieść nowy.
Krok 6
-Powtórz poprzedni krok, aby zastąpić wartości i utworzyć nowe równanie, aż znajdziesz wszystkie współczynniki.
Krok 7
-Wymień w ten sposób określone wartości. Jeśli te wartości są całości, należy zweryfikować, że równanie było zrównoważone. Jeśli nie były całości, jest to mnożone przez minimalną wspólną wielokrotność mianowników, a równowaga jest sprawdzana.
Następnie wizualizujemy zastosowanie tych kroków w rozdzielczości niektórych przykładów.
Rozwiązane przykłady równoważenia
Przykład 1
W razie potrzeby zrównoważyć następującą reakcję, metodą algebraiczną:
N2ALBO5 → n2ALBO4 + ALBO2
Rozwiązanie
Zauważamy, że reakcja nie jest zrównoważona, ponieważ chociaż po obu stronach występują 2 atomy azotu, z tlenem po lewej.
Następnie musimy wykonać kroki opisane w poprzedniej sekcji:
-Ponownie piszemy równanie i rozmnażamy każdą cząsteczkę przez inny współczynnik. Wybierane są małe litery, aby nie były mylone z elementami:
A⋅n2ALBO5 → B⋅N2ALBO4 + C⋅o2
-Teraz wymieniamy każdy element i dopasowujemy ilości tego elementu w lewo i w prawo. Są to równania częściowe dla każdego elementu:
- A⋅n2 = B⋅n2
- A⋅o5 = B⋅o4 + C⋅o2
-Mnożenie współczynnika i indeks dolnej uzyskujemy liczbę atomów azotu. Z równania 1 otrzymujemy:
2a = 2b
-Równania 2 5 atomy tlenu po lewej stronie, po prawej stronie 4b I 2 c:
5a = 4b + 2c
-W ten sposób przypisujemy wartość 1 do współczynnika A:
A = 1
Ten wybór jest arbitralny, można go również wybrać najpierw B = 1.
-Wartości te są zastąpione w równaniu 2, aby określić wartość C:
Może ci służyć: tlenku miedzi (CUO)5 = 4 + 2c
2c = 5-4 = 1
C = ½
-Zastępujemy współczynniki w oryginalnym równaniu, 1 nie jest konieczne do wpisywania go jawnie:
N2ALBO5 → n2ALBO4 + ½ o2
-Ponieważ preferowane jest, aby współczynniki były całości, całe równanie jest mnożone przez minimalną wspólną wielokrotność mianowników, które wynoszą 2 i 1:
M.C.M. (1.2) = 2
Następnie, pomnożąc lewą i prawą przez 2, jest uzyskiwane:
2n2ALBO5 → 2n2ALBO4 + ALBO2
I liczymy liczbę atomów po obu stronach, aby sprawdzić saldo:
- N Po lewej: 4
- Lub po lewej: 10
- N Po prawej: 4
- Lub w prawo: 8 + 2 = 10
Przykład 2
Zrównoważyć następującą reakcję chemiczną:
Nahco3 → na2WSPÓŁ3 + H2Lub + co2
Rozwiązanie
Mnożymy każdą cząsteczkę przez inny współczynnik:
A⋅ Nahco3 → B⋅NA2WSPÓŁ3 + C⋅H2O + D⋅CO2
Następnie proponujemy rozliczenie każdego elementu po prawej i po lewej stronie strzałki. W reakcji jest w sumie 4 pierwiastki: sód na; Wodór H; Samochód i tlen lub wszystko należy policzyć:
- A⋅NA = B⋅NA2
- A⋅H = C⋅H2
- A⋅C = B⋅C + D⋅C
- A⋅o3 = B⋅o3+C⋅O+D⋅o2
Zgodnie z każdą równowagą uzyskuje się następujące równania:
1) A = 2b
2) A = 2C
3) A = B + D
4) A = 3b + C + 2d
Najbardziej powtarzający się współczynnik jest Do, Dlatego przypisujemy wartość 1:
A = 1
Więc:
1) A = 2b ⇒ B = ½
2) A = 2C ⇒ C = ½
3) A = B + D ⇒ D = A - B = 1 - ½ = ½ =
W równaniu zastępujemy współczynniki:
Nahco3 → ½. Na2WSPÓŁ3 + ½. H2O + ½.WSPÓŁ2
Mnożymy się po obu stronach strzałki przez 2, ponieważ jest to jedyny obecny mianownik, aby wyeliminować ułamek:
2nahco3 → na2WSPÓŁ3 + H2Lub + co2
Policzamy liczbę atomów obecnych po lewej: 2 atomy Na, H i C i 6 O. Czytelnik może sprawdzić, czy każdy z nich jest również obecny po prawej stronie w tych samych ilościach.
Bibliografia
- Atkins, str. Zasady chemii: ścieżki odkrycia. Pan -american Medical Redaktorial. Wydanie trzecie.
- Briceño, J. Przewodnik chemii USB. Odzyskany z: gecousb.com.Iść.
- Chang, R. 2013. Chemia. 11va. Wydanie. MC Graw Hill Education.
- Rozwiązane ćwiczenia. Balansowanie algebraiczne. Pobrano z: ćwiczenia uzupełnione.współ.
- Simoza, L. Równoważenie równań chemicznych. Odzyskane z: guao.org.

