Model materii
- 3783
- 230
- Estera Wojtkowiak
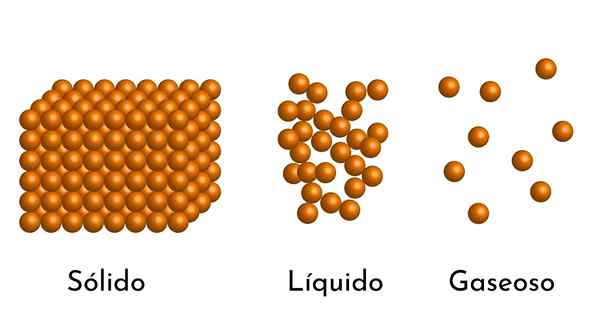
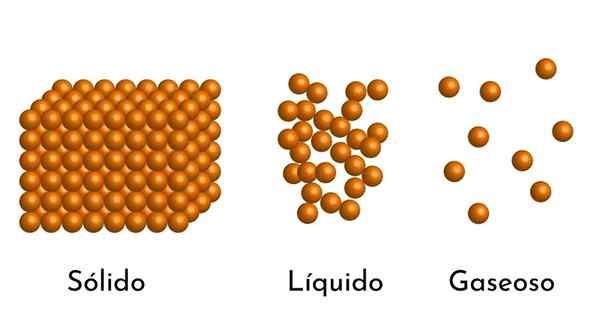 Najbardziej znane stany sprawy mają swoje wyjaśnienie w modelu korpuskularnym sprawy
Najbardziej znane stany sprawy mają swoje wyjaśnienie w modelu korpuskularnym sprawy Jaki jest korpusowy model materii?
On Model materii Jest to model mikroskopowej struktury materii, który ma na celu wyjaśnienie właściwości i zachowania w każdym stanie agregacji.
Podstawowym postulatem modelu jest to, że materia składa się z małych cząstek, które mogą być atomami, jonami lub cząsteczkami, zawsze w ciągłym mieszaniu.
W tym modelu obowiązują prawa mechaniki klasycznej do cząstek, chociaż według dużej liczby obecnych, nie są one badane indywidualnie, ale poprzez leczenie statystyczne. W ten sposób uzyskuje się średnie wartości makroskopowych wielkości, takie jak ciśnienie, temperatura i objętość.
Model korpuskularny wyjaśnia również właściwości, takie jak lepkość, twardość, elastyczność i gęstość materiałów, a także rozszerzenie termiczne, między innymi zjawiskami.
Pochodzenie korpuskularnego modelu materii
Pomysły na temat korpuskularnej natury materii są przynajmniej w V wieku.C. W starożytnej Grecji, Leucipo (450 a. C. - 370 a. C.) i Demokryt (460–370 do c), uczeń tego, spekulował na temat organizacji materii na poziomie mikroskopowym.
Ci filozofowie zaproponowali, że materia składa się z niewielkich niepodzielnych cząstek, mianowanych atomy, Słowo greckiego korzenia, które oznacza dokładnie „niepodzielny”.
Teorię została wykluczona przez Arystotelesa, najbardziej wpływowy mędrca swoich czasów. Jednak dopiero w XVII wieku teoria korpusarska zaczęła znów mieć znaczenie, aw XIX wieku tajemnice materii w końcu zaczęły ujawniać.
W 1803 r. Angielski chemik John Dalton (1766–1844) ponownie zaproponował, aby sprawa została utworzona przez korpusy zwane atomami, które łączyły się w pewnych proporcjach w celu utworzenia cząsteczek substancji.
Atomy Daltona były niepodzielne, ale wkrótce opracowano solidną strukturę teoretyczną, szczególnie dzięki Jamesowi C. Maxwell (1831-1979) i Ludwig Boltzmann (1844-1906). To ustaliło podstawy mechaniki statystycznej i fizyka stanu stałego.
Może ci służyć: średnia prędkość: wzory, jak jest obliczany i rozwiązanyPodstawy korpuskularnego modelu materii
Główne postulaty modelu to:
- Materia, niezależnie od ich statusu agregacji, powstaje przez cząstki mikroskopowe, które mogą być atomami indywidualnymi lub kombinowanymi, tworząc cząsteczki.
- Różne substancje różnią się od siebie, ponieważ są one składane przez różne cząstki.
- Zgodnie ze stanem agregacji materii istnieją puste przestrzenie między cząsteczkami, większe w gazach i mniejsze w ciałach stałych.
- Cząsteczki, które stanowią tę sprawę, są w ciągłym mieszaniu. Do większego pobudzenia, większa energia kinetyczna, którą mają, a jeśli dodano ciepło, ruch cząstek jest zwiększony.
- Ponadto w cieczach i ciałach stałych cząstki doświadczają przyciągania różnej intensywności, z powodu sił międzycząsteczkowych. W gazach cząsteczki są bardzo oddzielne i poruszają się szybko, więc siły te nie mają większej częstości występowania. Ale w cieczach, których cząsteczki mają większą spójność, siły te są bardziej intensywne, a w ciałach stałych jest jeszcze większe.
Kinetyczna teoria gazów
Model korpuskularny zastosowano najpierw do gazów, ponieważ jest to najprostszy stan agregacji, a siły spójności między cząsteczkami są minimalne. Ponadto właściwości gazów były dobrze znane przez eksperymentalne dzieła angielskiego chemika Roberta Boyle'a i francuskiego Josepha Gay Lussaca i Jacquesa Charlesa.
Model gazów idealnych, najprostszy, rozważa:
- Rozmiar cząstek jest znacznie mniejszy niż odległości między nimi i że wymiary pojemnika. Są to specyficzne masy, to znaczy pozbawione wymiarów i nie zajmują objętości.
- Cząstki są w stałym mieszaniu, będąc tylko ich ruchem tłumaczenia.
- Czasami cząsteczki zderzają się elastycznie, ze sobą i ze ścianami pojemnika. W całkowicie elastycznych wstrząsach zachowuje się energia kinetyczna.
- Nie ma sił atrakcyjnych między cząsteczkami. Jedyne interakcje to kolizje, które występują od czasu do czasu i przez bardzo krótki czas. Reszty każda cząsteczka działa niezależnie od innych.
- Jeśli nie ma sił zewnętrznych działających na system cząstek, są one równomiernie rozmieszczone w dostępnej objętości.
Chociaż jest to najprostszy model, wyjaśnia zachowanie dowolnego gęstego gazu w wysokich temperaturach i niskich ciśnieniach. Naukowcy opracowali inne lepiej skorygowane modele na zachowanie prawdziwych gazów, w tym celu uważają, że:
- Cząsteczki mają wymierny rozmiar.
- Siły międzycząsteczkowe nie są anulowane.
Idealne równanie gazu
Dzięki postulatom gazu idealnego powstaje wyrażenie, które dotyczą makroskopowych wielkości ciśnienia P, objętości V i temperatury T:
P ∙ V = NRT
Gdzie n jest liczbą moli gazu, a r jest uniwersalną stałą gazów, których wartość w międzynarodowych jednostkach systemowych wynosi 8.314 J/mol ∙ k.
Energia kinetyczna i temperatura
W gazach idealnym cała energia wewnętrzna objawia się energii kinetycznej. Średnia energia kinetyczna n cząsteczek idealnego gazu jest wprost proporcjonalna do jego temperatury w Kelvin:
Model korpusowy w cieczach i stałych
W rzeczywistości całą materię można znaleźć w trzech najprostszych stanach: takich jak gaz, ciecz lub ciało stałe, w zależności od ciśnienia i temperatury. Istnieją inne stany agregacji, takie jak plazma, ale nie blisko powierzchni ziemi.
Stany te wynikają ze sposobu, w jaki działają siły przyciągania międzycząsteczkowe, które są krótkie, to znaczy nie działają, jeśli odległość między cząsteczkami jest bardzo duża, a cząsteczki poruszają się z dużą prędkością. Tak jest w przypadku gazów, co pozwala na zjawisko dyfuzja szybciej. To wyjaśnia, że odkrywając aromat, aromat szybko się rozprzestrzenia.
Może ci służyć: jaki jest moment magnetyczny?Z drugiej strony, gdy cząstki są bliżej, a ich ruch jest wolniej.
Zatem, gdy gaz przechodzi do stanu ciekłego, jego objętość maleje, ponieważ odległość między jego cząstkami maleje, a nawet więcej, gdy staje.
Materia w stanie płynnym
W stanie płynnym siły międzycząsteczkowe nie są nikczemne, ale działają na mniejszą skalę niż w stanie stałym. Cząstki tworzą małe grupy, które rozpadają się i przegrupowują w sposób ciągły, zapewniając mobilność materiału, chociaż utrzymują stałą objętość.
Ta mobilność pozwala płynom dostosować się do kształtu pojemnika i daje im możliwość przepływu, oprócz łatwiejszego mieszania. Może wystąpić dyfuzja, ale wolniej niż w gazach.
Mimo to cząsteczki mają wystarczającą spójność, aby ciecz pozostała nieściśliwa w szerokim zakresie temperatur.
Napięcie powierzchniowe
Na powierzchni płynu znajdują się cząsteczki, na których działają niezrównoważone siły międzycząsteczkowe, powodując wzrost siły netto. Ta siła netto jest minimalizowana, gdy ciecz ma najniższą możliwą powierzchnię.
Dzięki tej sile, szpilki, klips, owadów i innych małych przedmiotach udaje się pozostać na nieruchomej powierzchni wody bez tonięcia.
 Na tym obrazie na powierzchni cieczy można zobaczyć cząsteczkę, na której działa siła netto, co pozwala owadowi chodzić po wodzie bez tonięcia
Na tym obrazie na powierzchni cieczy można zobaczyć cząsteczkę, na której działa siła netto, co pozwala owadowi chodzić po wodzie bez tonięcia Materia stała
W stanie stałym cząstki są bardzo blisko siebie, a siły międzycząsteczkowe sprawiają, że cząstki pozostają w ustalonych pozycjach. Chociaż mogą wibrować wokół tej pozycji, ciałami stałe przyjmują określoną formę i utrzymują stałą objętość.
Gdy ciepło płynie, zwiększa się amplituda ruchu wibracyjnego, a temperatura wzrasta. To powoduje wzrost wymiarów ciała wraz z temperaturą, zjawisko zwane Rozszerzenie termiczne. Jeśli przepłynie wystarczająco dużo ciepła, ciał stał może nawet przejść do fazy ciekłej.


