Sommerfeld Charakterystyka modelu atomowego, postuluje, zalety i wady
- 3869
- 82
- Eliasz Dubiel
On Model atomowy Sommerfeld Został stworzony przez niemieckiego fizyka Arnolda Sommerfelda w latach 1915–1916, aby wyjaśnić fakty, że model Bohr, wydany wkrótce przed 1913 r., Nie mógł zadowalająco wyjaśnić. Sommerfeld przedstawił swoje wyniki najpierw Bavaria Academy of Sciences, a następnie opublikował je w magazynie Annalen der Physik.
Model atomu zaproponowany przez duńskiego fizyka Nielsa Bohra opisuje.
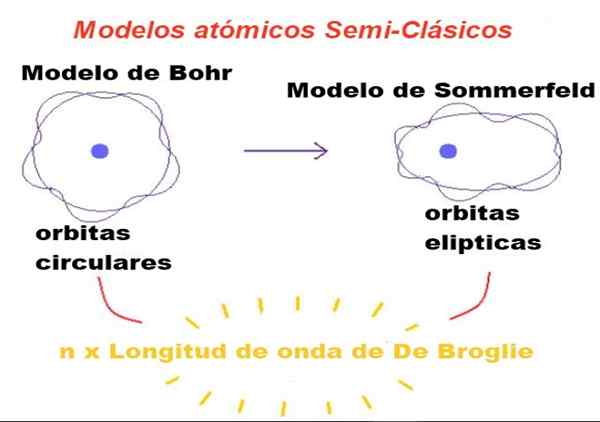
 Rysunek 1. W modelach półklasycznych orbity to Newtonian, ale tylko ci, których obwód jest liczbą całkowitą liczbą razy długość fali broglie. Źródło: f. Zapata.
Rysunek 1. W modelach półklasycznych orbity to Newtonian, ale tylko ci, których obwód jest liczbą całkowitą liczbą razy długość fali broglie. Źródło: f. Zapata. W teorii zaproponowanej przez Bohra elektron, który krąży wokół jądra, może mieć tylko pewne wartości jego orbitalnego momentu kątowego, a zatem nie może być na żadnej orbicie.
Bohr uznał również, że te orbity były okrągłe, a pojedyncza liczba kwantowa nazywała Główny numer kwantowy n = 1, 2, 3 ... służył do identyfikacji dozwolonych orbit.
Pierwsza modyfikacja wprowadzona przez Sommerfeld do modelu BOHR polegała na założeniu, że orbita elektronów może być również eliptyczna.
Obwód jest opisany przez jego promień, ale w elipsie musisz podać dwa parametry: półsenije i niewielka połowa, oprócz orientacji przestrzennej tego samego. Dzięki temu wprowadził jeszcze dwie liczby kwantowe.
Drugą główną modyfikacją, którą dokonał Sommerfeld, było dodanie efektów relatywistycznych do modelu atomowego. Nie ma nic szybszego niż światło, jednak Sommerfeld znalazł elektrony o znacznie bliskich prędkościach, dlatego konieczne było włączenie efektów relatywistycznych do dowolnego opisu atomu.
[TOC]
Postulaty modelu atomowego sommerfelda
Elektrony podążają za okrągłymi i eliptycznymi orbitami
Elektrony w atomie podążają za orbitą eliptyczną (okrągłe orbity są szczególnym przypadkiem), a ich stan energii można scharakteryzować 3 liczbami kwantowymi: główną liczbą kwantową N, Wtórna liczba kwantowa lub liczba azymutalna L i magnetyczna liczba kwantowa ML.
Może ci służyć: sole binarneW przeciwieństwie do obwodu, elipsa ma większą półjjen.
Ale elipsy z tą samą główną osią, mogą mieć inne mniejsze pół -semi, w zależności od stopnia ekscentryczności. Ekcentryczność równa 0 odpowiada okręgu, więc nie wyklucza trajektorii kołowych. Ponadto w elipsach kosmicznych mogą mieć różne skłonności.
Dlatego Sommerfeld dodał do swojego modelu wtórną liczbę kwantową L, aby wskazać niewielką połowę i magnetyczną liczbę kwantową mL. W ten sposób wskazał, jakie są dozwolone orientacje przestrzenne orientacji eliptycznej.
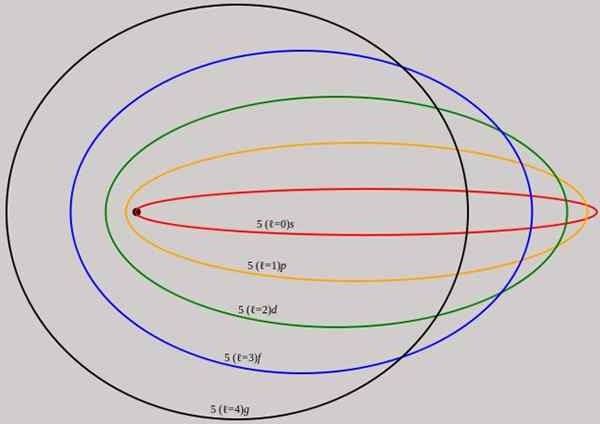 Rysunek 2. Orbity odpowiadające poziomowi energii n = 5 są pokazane dla różnych pędów kątowych, które mają pełne długości fali de Broglie. Źródło: Wikimedia Commons.
Rysunek 2. Orbity odpowiadające poziomowi energii n = 5 są pokazane dla różnych pędów kątowych, które mają pełne długości fali de Broglie. Źródło: Wikimedia Commons. Zauważ, że nie dodaje nowych głównych liczb kwantowych, więc całkowita energia elektronu na orbicie eliptycznej jest taka sama jak w modelu BOHR. Dlatego nie ma nowych poziomów energii, ale rozwijanie poziomów podanych przez liczbę n.
Efekt Zeeman i efekt surowy
W ten sposób można całkowicie określić daną orbitę, dzięki 3 wymienionym liczbom kwantowym, a tym samym wyjaśnić istnienie dwóch efektów: efektu Zeemana i efektu surowego.
I tak wyjaśnia rozwój energii, która pojawia się w normalnym efekcie Zeemana (istnieje również anomalny efekt Zeemana), w którym linia widmowa jest podzielona na kilka składników, gdy jest ona w obecności pola magnetycznego.
To rozwijanie linii występuje również w obecności pola elektrycznego, znanego jako efekt Stark, który skłoniła Sommerfelda do zastanowienia się nad modyfikacją modelu BOHR w celu wyjaśnienia tych efektów.
Jądro atomowe i elektrony poruszają się po środku masy
Po tym, jak Ernest Rutherford odkrył jądro atomowe i że fakt, że prawie cała masa atomu jest tam skoncentrowana, naukowcy uważali, że jądro było mniej lub bardziej stacjonarne.
Może ci służyć: wodorotlenek litu (lioh)Jednak Sommerfeld postulował, że zarówno jądro, jak i elektrony na orbicie poruszają się po środku masy systemu, co oczywiście jest bardzo blisko jądra. Jego model wykorzystuje zmniejszoną masę układu elektronowego - nukleusa, zamiast masy elektronowej.
Na orbitach eliptycznych, podobnie jak w przypadku planet wokół Słońca, są chwile, kiedy elektron jest bliżej, aw innych dalej od jądra. Dlatego jego prędkość jest inna w każdym punkcie jego orbity.
 Rysunek 3.- Arnold Sommerfeld. Źródło: Wikimedia Commons. Gfhund [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)].
Rysunek 3.- Arnold Sommerfeld. Źródło: Wikimedia Commons. Gfhund [CC przez 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]. Elektrony mogą osiągnąć prędkości relatywistyczne
Sommerfeld wprowadził do swojego modelu stałą drobnej struktury, stała bez wymiarów związanych z siłą elektromagnetyczną:
α = 1/137.0359895
Jest zdefiniowany jako iloraz między obciążeniem elektronów I Ja kwadratowo i produkt między stałą Plancka H i prędkość światła C W próżni, wszystkie pomnożone przez 2π:
α = 2π (e2/H.c) = 1/137.0359895
Stała drobna struktura dotyczy trzech najważniejszych stałych fizyki atomowej. Drugi to masa elektronu, która nie pojawia się tutaj.
W ten sposób jest powiązany z elektronami z fotonami (które poruszają się z prędkością C w pustce), a tym samym wyjaśniają odchylenia niektórych linii widmowych atomu wodoru prognoz przez model BOHR.
Dzięki relatywistycznym korektom poziomy energii z równymi N Ale inne L Oddzielają się, powodując strukturę drobnej struktury, stamtąd nazwa stałej α.
I wszystkie charakterystyczne długości atomu można wyrazić w kategoriach tej stałej.
 Rysunek 4. Pokazano kwantyzację pędu kątowego. W przeciwieństwie do okrągłych orbit, eliptyczny. Źródło: f. Zapata.
Rysunek 4. Pokazano kwantyzację pędu kątowego. W przeciwieństwie do okrągłych orbit, eliptyczny. Źródło: f. Zapata. Zalety i wady
Zalety
-Sommerfeld wykazał, że pojedyncza liczba kwantowa była niewystarczająca do wyjaśnienia linii widmowych atomu wodoru.
-Był to pierwszy model, który zaproponował kwantyzację przestrzenną, ponieważ projekcje orbit w kierunku pola elektromagnetycznego są w efekcie kwantyzowane.
Może ci służyć: stan plazmowy: cechy, typy i przykłady-Model sommerfeld w zadowalająco wyjaśnił, że elektrony o tej samej głównej liczbie kwantowej n różnią się w stanie energii, ponieważ mogą mieć różne liczby kwantowe L i ML.
-Wprowadził stały α w celu opracowania drobnej struktury widma atomowego i wyjaśnienia efektu Zeemana.
-Obejmowało efekty relatywistyczne, ponieważ elektrony mogą poruszać się z prędkościami dość blisko światła.
Niedogodności
-Jego model miał zastosowanie tylko do atomów z elektronem i pod wieloma względami do atomów metali alkalicznych, takich jak Li2+, Ale nie jest to przydatne w atomie helu, który ma dwa elektrony.
-Nie wyjaśniono rozkładu elektronicznego w atomie.
-Model dozwolony na obliczenie energii dozwolonych stanów i częstotliwości promieniowania wydanego lub wchłanianych w przejściach między stanami, bez przekazywania informacji o czasach tych przejść.
-Teraz wiadomo, że elektrony nie podążają za trajektoriami z z góry określonymi formami jako orbitami, ale zajmują Orbitale, regiony przestrzeni odpowiadające rozwiązaniom równań Schrodinger.
-Model arbitralnie połączony klasyczne aspekty z aspektami kwantowymi.
-Nie udało mu się wyjaśnić anomalnego efektu Zeemana, ponieważ jest to potrzebne przez model DIRAC, który później dodał kolejną liczbę kwantową.
Artykuły zainteresowane
Model atomowy Schrödingera.
Model atomowy Broglie.
Model atomowy Chadwick.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Dalton.
Model atomowy Dirac Jordan.
Model atomowy Leucipo.
Model atomowy Bohr.
Obecny model atomowy.
Bibliografia
- Brainkart. Model atomu sommerfeld i jego wady. Odzyskany z: Brainkart.com.
- Jak poznaliśmy kosmos: światło i materia. Atom Sommerfelda. Pobrano z: Taskatargarden.współ.Wielka Brytania
- Parker, str. Atom Bohr-Sommerfeld. Odzyskane z: physnet.org
- Kącik edukacyjny. Model sommerfeld. Odzyskane z: rinconucative.com.
- Wikipedia. Model atomowy Sommerfeld. Odzyskane z: jest.Wikipedia, org.

