Rutherford History Model, eksperymenty, postuluje
- 3232
- 51
- Matylda Duda
On Rutherford Atomic Model Jest to opis atomu stworzonego przez brytyjskiego fizyka Ernesta Rutherforda (1871–1937), kiedy w 1911 r. Odkrył jądro atomowe, dzięki słynnym wymienionym eksperymentom dyspersji, które są nazwane.
Pomysł atomu (”niepodzielny„Po grecku) jako najmniejszy element materii był to intelektualne stworzenie urodzone w starożytnej Grecji, około 300.C. Podobnie jak wiele innych greckich koncepcji, koncepcja atomu jest opracowana na podstawie logiki i argumentacji, ale nie na eksperymentach.
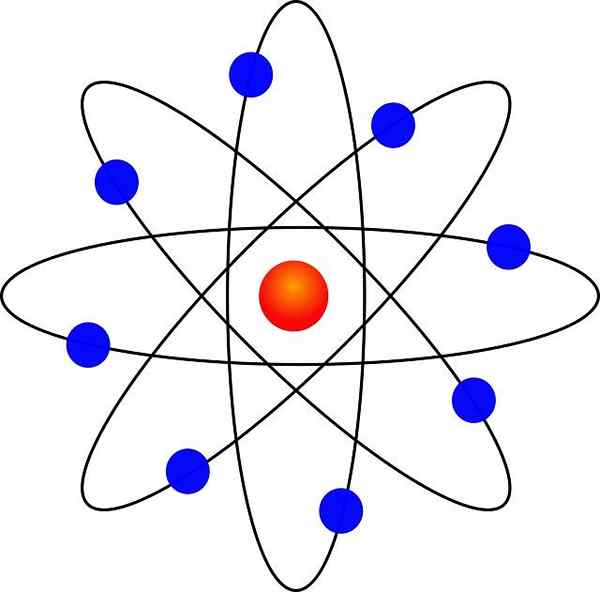
 Rutherford Atomic Model
Rutherford Atomic Model Najbardziej godnymi uwagi filozofami atomistyczni byli Demokryt Abdery (460 - 360 pne), Epikurus z Samos (341 - 270 AC) i Tito Lucrecio (98 - 54 AC). Grecy wymyślili cztery różne typy atomów, które odpowiadały czterem elementom, które według nich utworzyły materię: powietrze, woda, ziemia i ogień.
Następnie Arystoteles dodałby piąty element: eter, który utworzył gwiazdy, ponieważ pozostałe cztery elementy były czysto naziemne.
Podbój Aleksandra Wielkiego, którego Arystoteles był nauczycielem, rozszerzył swoje przekonania o starożytnym świecie, z Hiszpanii po Indie atom Stworzył swoje miejsce w świecie nauki.
[TOC]
Atom przestaje być niepodzielny
Idee greckich filozofów na temat struktury tematu były utrzymywane jako pewne przez setki lat, dopóki angielski chemik i nauczyciel o nazwie John Dalton (1776–1844) opublikował wyniki swoich eksperymentów w 1808 r.
Dalton zgodził się, że elementy składają się z bardzo małych cząstek, zwanych atomami. Ale poszło dalej, stwierdzając, że wszystkie atomy tego samego elementu są równe, mają ten sam rozmiar, tę samą masę i te same właściwości chemiczne, co sprawia, że pozostają niezmienione podczas reakcji chemicznej.
To pierwszy model atomowy z fundamentem naukowym. Podobnie jak Grecy, Dalton nadal uważał atom za niepodzielny, a zatem brakuje struktury. Jednak geniusz Daltona doprowadził go do obserwowania jednej z wielkich zasad ochrony fizyki:
- W reakcjach chemicznych, atomy nie są tworzone ani niszczone, Zmieniają tylko swój dystrybucja.
I ustalił sposób, w jaki związki chemiczne były tworzone przez „atomy złożone” (cząsteczki):
- Kiedy dwa lub więcej atomów różnych elementów jest łączone, aby utworzyć ten sam związek, zawsze robią to w proporcjach masowych zdefiniowane i stałe.
Dziewiętnasty wiek był wielkim wiekiem elektryczności i magnetyzmu. Kilka lat po publikacjach Daltona wyniki niektórych eksperymentów zasiała wątpliwości naukowców na temat niepodzielności atomu.
Może ci służyć: jaka jest reaktancja pojemnościowa i jak ją obliczyć?Rurka Crookesa
Crookes Tube była urządzeniem zaprojektowanym przez brytyjskiego chemika i meteorologa Williama Crookesa (1832–1919). Eksperyment, który przeprowadził krzywy w 1875 r katoda i inny zadzwonił anoda.
Ustanawiając potencjalną różnicę między obiema elektrodami, gaz lśnił kolorem charakterystycznym dla używanego gazu. Fakt ten sugerował, że w Atomie istniała pewna konkretna organizacja i dlatego nie było to niepodzielne.
Ponadto promieniowanie to spowodowało słabą fluorescencję w ścianie szklanej rurki przed katodą, wycinając cień znaku krzyżowego znajdującego się wewnątrz rurki.
Było to tajemnicze promieniowanie znane jako „promienie katodowe”, które podróżowało w linii prostej do anody i które było wysoce energetyczne, zdolne do wytwarzania efektów mechanicznych, i które odchylało się od pozytywnie załadowanej płyty lub magnesów.
Odkrycie elektronu
Promieniowania wewnątrz rurki Crookesa nie można leczyć, ponieważ miało obciążenie ujemne. Joseph John Thomson (1856–1940) znalazł odpowiedź w 1887 r., Kiedy znalazł związek między obciążeniem a masą tego promieniowania i stwierdził, że zawsze jest taki sam: 1,76 x 10jedenaście C/kg., Niezależnie od gazu zablokowanego w rurce lub materiału używanym do produkcji katody.
Thomson nazwał te cząstki Corpuscles. Mierząc swoją masę w stosunku do ładunku elektrycznego, doszedł do wniosku, że każdy korpus był znacznie mniejszy niż atom. Dlatego zasugerował, że powinni być ich częścią, odkrywając w ten sposób elektron.
Brytyjski naukowiec jako pierwszy przedstawił model graficzny atomu, poprzez rysowanie kuli z włożonymi punktami, które według jej formy otrzymało nazwę „Buddina Cirula”. Ale to odkrycie przyniosło inne pytania:
- Jeśli materia jest neutralna, a elektron ma obciążenie ujemne: w którym częścią atomu jest obciążenie dodatnie, które neutralizuje elektrony?
- Jeśli masa elektronów jest niższa niż atom, to z czego składa się reszta atomu?
- Dlaczego cząstki otrzymywano zawsze elektrony i nigdy innego typu?
Eksperymenty z dyspersją Rutherford: jądro atomowe i proton
Do 1898 r. Rutherford zidentyfikował dwa rodzaje promieniowania z uranu, które nazwał alfa I beta.
Naturalna radioaktywność została już odkryta przez Marie Curie w 1896 roku. Cząstki alfa mają obciążenie dodatnie i są po prostu jądrem helu, ale w tym czasie pojęcie rdzenia nie było jeszcze znane. Rutherford miał to odkryć.
Może ci służyć: System termodynamiczny: właściwości, typy, przykładyJeden z eksperymentów, które Rutherford przeprowadził w 1911 roku na Uniwersytecie Manchesteru, z pomocą Hansa Geigera alfa, którego obciążenie jest dodatnie. Wokół złotego arkusza umieścił ekran fluorescencyjny, który pozwolił im wizualizować efekty bombardowania.
Obserwacje
Badając wpływ na ekran fluorescencyjny, Rutherford i jego asystenci zauważyli, że:
- Wysoki odsetek cząstek alfa przekroczył arkusz bez zauważalnego odchylenia.
- Niektórzy odchylili się pod dość wyraźnym kątem
- I bardzo mało odbił się do tyłu
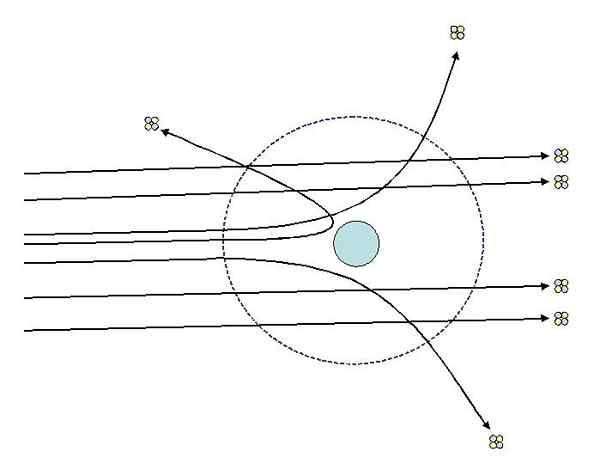 Eksperymenty z dyspersją Rutherford. Źródło: [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]].
Eksperymenty z dyspersją Rutherford. Źródło: [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Obserwacje 2 i 3 zaskoczyły śledczych i doprowadziły ich do założenia, że osoba odpowiedzialna za rozproszone promienie powinna mieć dodatnią ładunek i że na mocy obserwacji nr 1, ta osoba odpowiedzialna miała znacznie mniejszy rozmiar niż cząstki alfa.
Sam Rutherford powiedział pod tym względem, że to było „... jakbyś próbował 15 -calowego pocisku morskiego przeciwko arkuszowi papieru i pocisku odepchnął się i uderzył cię”. Można to zdecydowanie wyjaśnić modelem Thompsona.
Analizując swoje wyniki z klasycznego punktu widzenia, Rutherford odkrył istnienie jądra atomowego, w którym skoncentrowano pozytywne obciążenie atomu, które dało tę neutralność.
Rutherford kontynuował eksperymenty z dyspersją. W 1918 r. Nowym celem cząstek alfa były atomy gazowego azotu.
W ten sposób wykrył jądra wodoru i natychmiast wiedział, że jedyne miejsce, z którego te jądra mogą pochodzić z samego azotu. Jak możliwe było, że jądra wodoru były częścią azotu?
Rutherford zasugerował następnie, że rdzeń wodoru, element, którego już przypisano atomową liczbę 1, powinien być podstawową cząsteczką. dzwonię do niej proton, Greckie słowo do wyznaczenia Pierwszy. Zatem odkrycia jądra atomowego i protonu wynikają z tego genialnego neozyre.
Postuluje model atomowy Rutherforda
Nowy model był bardzo różny od Thompsona. To były jego postulaty:
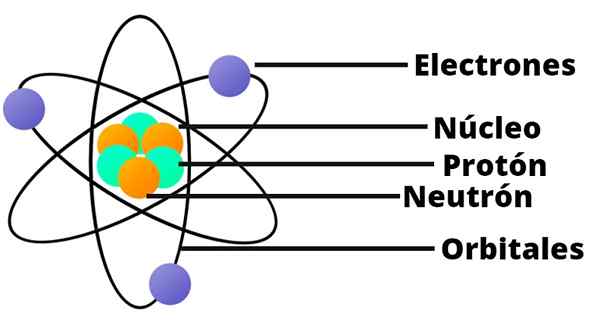
- Atom zawiera pozytywnie obciążony rdzeń, który pomimo bardzo małego, zawiera prawie całą masę atomu.
- Elektrony krążą jądro atomowe w dużej odległości i na orbitach okrągłe lub eliptyczne.
- Obciążenie netto atomu jest nieważne, ponieważ ładunki elektronów kompensują dodatnie obciążenie obecne w jądrze.
Obliczenia Rutherforda wskazywały na kuliste jądro i radio tak małe jak 10-piętnaście m, będąc wartością promienia atomowego około 100.000 razy wyższe, ponieważ jądra są stosunkowo bardzo odległe od siebie: od rzędu 10-10 M.
 Młody Ernest Rutherford. Źródło: Nieznane, opublikowane w 1939 roku w Rutherford: Being the Life and Letters of the RT. Hon. Lord Rutherford, lub. M [CC przez 4.0 (https: // creativeCommons.Org/licencje/według/4.0)]
Młody Ernest Rutherford. Źródło: Nieznane, opublikowane w 1939 roku w Rutherford: Being the Life and Letters of the RT. Hon. Lord Rutherford, lub. M [CC przez 4.0 (https: // creativeCommons.Org/licencje/według/4.0)] To wyjaśnia, dlaczego większość cząstek alfa przekroczyła arkusz bez niedogodności lub prawie nie miała bardzo małego ugięcia.
Widziane w codziennych obiektach atom Rutherforda składałby się z rdzenia wielkości baseballu, podczas gdy promień atomowy wynosiłby około 8 km. Dlatego atom można uznać prawie wszystko za pustą przestrzeń.
Dzięki podobieństwie do miniaturowego układu słonecznego był znany jako „model planetarny atomu”. Elektrostatyczna siła przyciągania między jądrem a elektronami byłaby analogiczna do przyciągania grawitacyjnego między słońcem a planetami.
Ograniczenia
Jednak istniały pewne spory dotyczące niektórych zaobserwowanych faktów:
- Jeśli pomysł, że orbita elektronowa wokół jądra jest zaakceptowana, zdarza się, że elektron powinien stale emitować promieniowanie, dopóki nie zderzy się z jądrem, z wynikającym z tego zniszczeniem atomu za znacznie mniej niż sekundę. To na szczęście nie jest to, co się naprawdę dzieje.
- Ponadto, w niektórych przypadkach atom emituje pewne częstotliwości promieniowania elektromagnetycznego, gdy występują przejścia między stanem większej energii do jednej z mniejszą energią, a tylko te częstotliwości, a nie inne. Jak wyjaśnić fakt, że energia jest kwantyzowana?
Pomimo tych ograniczeń i że dziś istnieją znacznie bardziej wyrafinowane modele i zgodnie z obserwowanymi faktami, model atomowy Rutherforda jest nadal przydatny dla studenta, aby mieć pierwsze udane podejście atomu i jego cząstek składowych.
W tym modelu atomu neutron nie pojawia się kolejny składnik jądra, który nie został odkryty dopiero w 1932 r.
Krótko po tym, jak Rutherford zaproponował swój model planetarny, w 1913 r.
Artykuły zainteresowane
Model atomowy Schrödingera.
Model atomowy Broglie.
Model atomowy Chadwick.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Dirac Jordan.
Model atomowy Democritus.
Model atomowy Bohr.
Model atomowy Dalton.
Bibliografia
- Rex, a. 2011. Podstawy fizyki. osoba. 618-621.
- Zapata, f. 2007. Uwagi klasowe dla radiobiologii i krzesła ochronnego radiologicznego. Szkoła zdrowia publicznego Central University of Wenezuela.

