Charakterystyka linków jonowych, jak formy i przykłady

- 1222
- 62
- Pani Waleria Marek
On Link jonowy Jest to rodzaj wiązania chemicznego, w którym istnieje przyciąganie elektrostatyczne między jonami z przeciwnym obciążeniem. Oznacza to, że dodatnio załadowany jon tworzy związek z jonem ujemnie obciążonym, przenosząc elektrony z jednego atomu do drugiego.
Ten rodzaj wiązania chemicznego występuje, gdy elektron walencyjny jednego atomu są trwale przenoszone do innego. Atom, który traci elektrony, staje się kationem (dodatnio załadowanym), a ten, który zyskuje elektrony, staje się anionem (negatywnie załadowanym).
 Przykład wiązania jonowego: fluorek sodu. Sód traci elektron Valencia i daje mu fluor. WDCF [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Przykład wiązania jonowego: fluorek sodu. Sód traci elektron Valencia i daje mu fluor. WDCF [CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0)] [TOC]
Koncepcja linków jonowych
Wiązanie jonowe polega na tym, że cząsteczki naładowane elektrycznie, zwane jonami, oddziałują na powstanie stałych i cieczy jonowych. Ten link jest produktem interakcji elektrostatycznych między setkami milionów jonów i nie jest ograniczone tylko do kilku z nich; Oznacza to, że wykracza poza przyciąganie między dodatnim obciążeniem w kierunku obciążenia ujemnego.
Rozważmy na przykład złożony złożony chlorek sodu, NaCl, znany najlepiej jako sól stołowa. W NaCl dominuje wiązanie jonowe, więc składa się z jonów Na+ i Cl-. Następnie+ Jest to dodatni jon lub kation, podczas gdy Cl- (Chlorek) to jon ujemny lub anion.
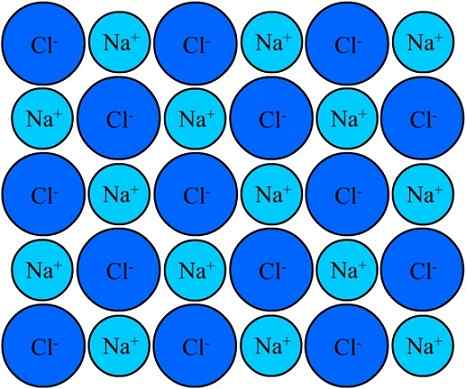 Na+ i jony w chlorku sodu pozostają zjednoczone dzięki więzi jonowej. Źródło: Eyal Bairey przez Wikipedia.
Na+ i jony w chlorku sodu pozostają zjednoczone dzięki więzi jonowej. Źródło: Eyal Bairey przez Wikipedia. Oba na+ Jak CL- Przyciągają je przeciwne ładunki elektryczne. Odległości między tymi jonami pozwalają innym podejść, tak że pojawiają się pary i pary NaCl. Katory na+ Będą odstraszać ze sobą za równe obciążenia, i to samo dzieje się ze sobą z anionami Cl-.
Nadchodzi czas, kiedy miliony jonów Na+ i Cl- Udaje im się zjednoczyć, spójne, powstrzymują strukturę tak stabilną, jak to możliwe; Rządzony przez link jonowy (obraz doskonały). Katory na+ Są mniejsze niż aniony CL- Z powodu rosnącej skutecznej siły jądrowej jej jądra na elektronach zewnętrznych.
 Nacl Ionic Link. Rhannosh/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)
Nacl Ionic Link. Rhannosh/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Wiązanie jonowe charakteryzuje się ustanowieniem uporządkowanych struktur, w których odległość między jonami (na+ i Cl- W przypadku NaCl) jest mały w porównaniu z innymi ciałami stałymi. Mówi się o strukturze krystalicznej jonowej.
Jak wygląda link jonowy?
Wiązanie jonowe ma miejsce tylko wtedy, gdy wystąpi rozkład elektronów. Ten rodzaj łącza nigdy nie może wystąpić między cząstkami neutralnymi. Muszą istnieć kationów i anionów. Ale skąd pochodzą?
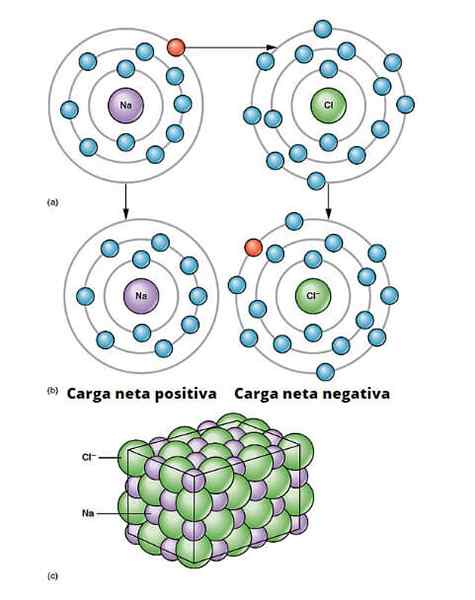 Ilustracja linków jonowych. a) Sód ma ujemne obciążenie netto. b) Sód podaje elektron do chloru. Sód ma dodatnie obciążenie netto i chlor o ujemnym obciążeniu netto, generując wiązanie jonowe. Ten rodzaj związku między milionami atomów Na i Cl powoduje powstanie fizycznej soli. Openx College/CC przez (https: // creativeCommons.Org/licencje/według/3.0)
Ilustracja linków jonowych. a) Sód ma ujemne obciążenie netto. b) Sód podaje elektron do chloru. Sód ma dodatnie obciążenie netto i chlor o ujemnym obciążeniu netto, generując wiązanie jonowe. Ten rodzaj związku między milionami atomów Na i Cl powoduje powstanie fizycznej soli. Openx College/CC przez (https: // creativeCommons.Org/licencje/według/3.0) Istnieje wiele sposobów, dla których jony pochodzą, ale w istocie wiele opiera się na reakcji ograniczania utleniania. Większość nieorganicznych związków jonowych składa się z elementu metalicznego z elementem niemetalicznym (element bloku P stolika okresowego).
Metal musi utleniać, stracić elektrony, aby przekształcić się w kation. Z drugiej strony element niemetaliczny jest zmniejszony, zyskuje te elektrony i staje się anionem. Poniższy obraz ilustruje ten punkt tworzenia NaCl z atomów sodu i chloru:
Może ci służyć: kwas arsenowy (H3SO4): właściwości, ryzyko i zastosowania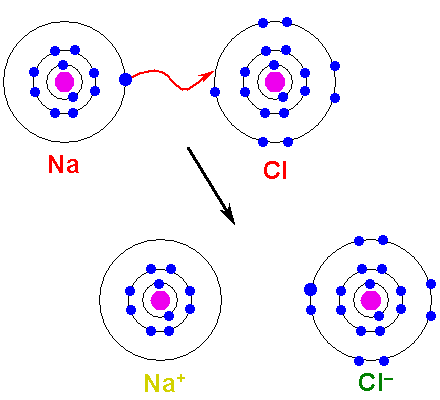 Tworzenie linku jonowego. Źródło: Shafei w arabskiej Wikipedii / domenie publicznej
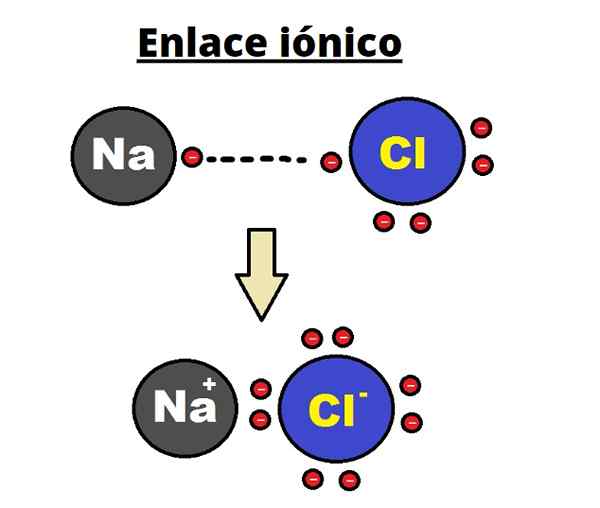
Tworzenie linku jonowego. Źródło: Shafei w arabskiej Wikipedii / domenie publicznej Atom NA przekazuje jeden ze swoich elektronów Valencia na CL. Gdy wystąpi ten rozkład elektronów, powstają jony NA+ i Cl-, które zaczynają natychmiast przyciągać i elektrostatycznie.
Mówi się zatem, że na+ i Cl- Nie dzielą żadnej pary elektronów, w przeciwieństwie do tego, czego można się spodziewać w przypadku hipotetycznego kowalencyjnego wiązania NA-CO-CO.
Właściwości linków jonowych
Wiązanie jonowe jest nie -kierunkowe, to znaczy, że jego siła nie jest obecna w jednym kierunku, ale jest propagowana przez przestrzeń na podstawie odległości, które oddzielają jony. Fakt ten jest ważny, ponieważ oznacza, że jony są silnie zjednoczone, co wyjaśnia kilka właściwości fizycznych jonowych stałych.
Temperatura topnienia
Wiązanie jonowe jest odpowiedzialne za sól do temperatury 801 ° C. Ta temperatura jest znacznie wysoka w porównaniu z punktami fuzyjnymi kilku metali.
Wynika to z faktu, że NaCl musi wchłonąć wystarczającą ilość ciepła, aby jego jony zaczęły swobodnie płynąć poza kryształami; to znaczy, należy pokonać atrakcje między NA+ i Cl-.
Punkt wrzenia
Punkty fuzji i wrzenia związków jonowych są szczególnie wysokim produktem ich silnych interakcji elektrostatycznych: wiązania jonowego. Ponieważ jednak ten link obejmuje wiele jonów, zachowanie to jest zwykle przyznawane siłom międzycząsteczkowym, a nie właściwie na więź jonową.
W przypadku soli, po stopieniu NaCl, uzyskana jest ciecz złożona z tych samych początkowych jonów; Dopiero teraz poruszają się z większą wolnością. Link jonowy jest nadal obecny. Jony NA+ i Cl- Spotykają się na powierzchni cieczy, aby stworzyć wielkie napięcie powierzchniowe, co zapobiega ucieczce jonów.
Dlatego stopiona sól musi jeszcze bardziej zwiększyć swoją temperaturę do wrzenia. Punktem wrzenia NaCl wynosi 1465 ° C. W tej temperaturze ciepło przekracza atrakcje między NA+ i Cl- W cieczy, więc opary NaCl zaczynają tworzyć się z ciśnieniem równym atmosferycznym.
Elektronialiczność
Wcześniej powiedziano, że wiązanie jonowe powstaje między elementem metalicznym a elementem niemetalicznym. W rachunkach podsumowujących: między metalem a nie -metalowym. Zwykle dotyczy to nieorganicznych związków jonowych; Przede wszystkim te typu binarnego, takie jak NaCl.
Dla dystrybucji elektronów (na+Cl-), a nie dzielenie się (NA-CL), musi istnieć duża różnica elektroonegatywności między obiema atomami. W przeciwnym razie nie byłoby między nimi żadnego związku jonowego. Prawdopodobnie podejście Na i Cl, oddziałują, ale natychmiast CL, ze względu na większą elektrooniczność, „porywa” elektron do Na.
Jednak ten scenariusz dotyczy tylko związków binarnych, MX, takich jak NaCl. W przypadku innych soli lub związków jonowych ich procesy szkoleniowe są bardziej skomplikowane i nie można ich rozwiązać z perspektywy atomowej lub molekularnej.
Może ci służyć: AlquinosChłopaki
Nie ma różnych rodzajów wiązań jonowych, ponieważ zjawisko elektrostatyczne jest czysto fizyczne, zmieniając się tylko w sposób, w jaki jony oddziałują, lub liczba posiadanych atomów; to znaczy, jeśli są jony monoatomowe lub poliatomiczne. Również każdy element lub związek powoduje charakterystyczny jon, który określa naturę związku.
W sekcji przykłady punkt ten zostanie pogłębiony i okaże się, że łącze jonowe jest takie samo w istocie we wszystkich związkach. Kiedy nie jest to spełnione, mówi się, że więź jonowa ma pewien charakter kowalencyjny, co ma miejsce w przypadku wielu metali przejściowych, w których aniony są koordynowane z kationami; Na przykład FECL3 (Wiara3+-Cl-).
Przykłady linków jonowych
Kilka związków jonowych zostanie wymienionych poniżej, a ich jony i proporcje zostaną wyróżnione:
- Chlorek magnezu
MGCL2, (Mg2+Cl-), W proporcji 1: 2 (mg2+: 2 Cl-)
- Fluor potasowy
Kf, (k+F-), W proporcji 1: 1 (k+: F-)
- Siarczka sodu
Na2S, (na+S2-), W proporcji 2: 1 (2+: S2-)
- Wodorotlenek Lito
Lioh, (Li+Oh-), W proporcji 1: 1 (Li+: Oh-)
- Fluor wapnia
CAF2, (AC2+F-), W proporcji 1: 2 (CA2+: 2f-)
- Węglan sodu
Na2WSPÓŁ3, (Na+WSPÓŁ32-), W proporcji 2: 1 (2+: Co32-)
- Węglan wapnia
Złodziej3, (AC2+WSPÓŁ32-), W proporcji 1: 1 (CA2+: Co32-)
- Nadmanganian potasu
Kmno4, (K+Mne4-), W proporcji 1: 1 (k+: Mn4-)
- Siarczan miedzi
Cuso4, (Cu2+południowy zachód42-), W proporcji 1: 1 (cu2+: WIĘC42-)
- Wodorotlenek baru
BA (OH)2, (BA2+Oh-), W proporcji 1: 2 (BA2+: Oh-)
- Aluminiowy bromek
Alba3, (Do3+Br-), w proporcji 1: 3 (do3+: 3br-)
- Tlenek żelaza (iii)
Wiara2ALBO3, (Wiara3+ALBO2-), W proporcji 2: 3 (2fe3+: 32-)
- Tlenek strontu
Sro, (sr2+ALBO2-), W proporcji 1: 1 (SR2+: ALBO2-)
- Srebrny chlorek
AGCL, (ag+Cl-), W proporcji 1: 1 (AG+: Cl-)
- Inni
-Ch3CONA (wybierz3Gruchać-Na+), W proporcji 1: 1 (Cho3Gruchać-: Na+)
- NH4I (NH4+Siema-), W proporcji 1: 1 (NH4+: SIEMA-)
Każdy z tych związków przedstawia wiązanie jonowe, w którym miliony jonów, odpowiadające ich wzorom chemicznym, są przyciągane elektrostatycznie i pochodzą z ciała stałego. Im większa wielkość jego obciążeń jonowych, tym bardziej intensywne będą atrakcje i odpychanie elektrostatyczne.
Dlatego wiązanie jonowe zwykle jest silniejsze, im większe ładunki jonów, które tworzą związek.
Może ci służyć: alkenyRozwiązane ćwiczenia
Niektóre ćwiczenia, które umieszczają podstawową wiedzę na temat linku jonowego, zostaną rozwiązane poniżej.
- Ćwiczenie 1
Które z poniższych związków jest jonowe? Opcje to: HF, H2Lub, nie, h2S, NH3 i MGO.
Związek jonowy musi z definicji mieć wiązanie jonowe. Im większa różnica w elektroonywatywności między jej elementami składowymi, tym większy charakter jonowy wspomnianego ogniwa.
Dlatego opcje, które nie mają elementu metalicznego, są zasadniczo odrzucane: hf, h, h, h, h2Lub h2S i NH3. Wszystkie te związki są tworzone tylko przez elementy niemetaliczne. Kation NH4+ Jest to wyjątek od tej reguły, ponieważ nie ma metalu.
Pozostałe opcje to Nah i MGO, które odpowiednio mają metale NA i Mg, zjednoczone z elementami nie -metalowymi. Nah (na+H-) i MGO (MG2+ALBO2-) Są związkami jonowymi.
- Ćwiczenie 2
Rozważ następujący hipotetyczny związek: AG (NH4)2WSPÓŁ3Siema. Jakie są twoje jony i w jakiej proporcji są w stałym?
Rozkładając związek na ich jonach: AG+, NH4+, WSPÓŁ32- i ja-. Są one połączone elektrostatycznie zgodnie z proporcją 1: 2: 1: 1 (Ag+: 2nh4+: Co32-: SIEMA-). Oznacza, że ilość kationów NH4+ To jest podwójne dla jonów ag+, WSPÓŁ32- i ja-.
- Ćwiczenie 3
Które z poniższych związków można by oczekiwać zasadniczo, jak najsilniejszy link jonowy miał? Opcje to: KBR, CAS, NA2południowy zachód4, Cuo, Alpo4 i Pb3P4.
KBR składa się z k jonów+ i br-, Z wielkością obciążenia. Następnie CAS ma jony CA2+ i s2-, Przy obciążeniach o podwójnej wielkości, aby można by pomyśleć, że łącze jonowe w CA jest silniejsze niż w KBR; A także silniejsze niż w Na2południowy zachód4, ponieważ ten ostatni składa się z jonów Na+ A więc42-.
Zarówno CAS, jak i CUO mogą mieć równy silny łącznik jonowy, ponieważ oba zawierają jony z obciążeniami o podwójnej wielkości. Wtedy mamy alpo4, z jonami al3+ i Po43-. Jony te mają potrójne obciążenia wielkości, więc link jonowy w alpo4 Powinien być silniejszy niż we wszystkich powyższych opcjach.
I wreszcie mamy zwycięzcę PB3P4, Cóż, jeśli założymy, że jest to utworzone przez jony, stają się PB4+ I p3-. Ich ładunki mają największe wielkości; I dlatego PB3P4 Jest to związek, który prawdopodobnie ma najsilniejsze wiązanie jonowe.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Wiązanie jonów. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (11 lutego 2020). Wiązania jonowe vs kowalencyjne - zrozum różnicę. Odzyskane z: Thoughtco.com
- Redaktorzy Enyclopaedia Britannica. (31 stycznia 2020). Wiązanie jonowe. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Słownik chemicool. (2017). Definicja wiązania jonowego. Odzyskane z: Chemicool.com
- « Funkcje równowagi Granrataria, części i jak z niej korzystać
- Rutherford History Model, eksperymenty, postuluje »

