Model atomowy Dalton

- 5055
- 255
- Filip Augustyn
Wyjaśniamy model atomowy Daltona, jego postulaty i ograniczenia
 Model atomowy Daltona był pierwszym opartym na badaniach naukowych. Źródło: f. Zapata.
Model atomowy Daltona był pierwszym opartym na badaniach naukowych. Źródło: f. Zapata. Jaki jest model atomowy Daltona?
On Model atomowy Dalton Proponuje, aby cała materia składa się z drobnych i niepodzielnych jednostek, zwanych atomami, w ten sposób odzyskując idee, które były greckie myśliciele sformułowały dwa tysiące lat temu.
Jest to pierwszy model atomowy, który wyłonił się z uważnych eksperymentów w laboratorium, ponieważ chociaż ludzkość zawsze starała się zrozumieć, co to jest, aż do początku XIX wieku możliwości eksperymentalnej weryfikacji teorii były nadal ograniczone.
Jednak oprócz tego, że jest dobrym obserwatorem przyrody, nauczyciel angielskiego John Dalton (1766-1844), również wyróżnił się w dziedzinie oprzyrządowania, ponieważ stworzył kilka urządzeń pomiarowych, które później użyłby w swoim laboratorium do studiowania nad Gazy.
W ten sposób Dalton zdał sobie sprawę, że substancje są łączone zgodnie z pewnymi zasadami i aby wyjaśnić, postulował, że cała materia składała się z atomów, maleńkich, jednorodnych kulek i braku struktury wewnętrznej. Atomy, powiedział, tworzą związki zgodnie z pewnymi proporcjami, a podczas reakcji chemicznej oddzielają się i łączą ponownie, tworząc nowe związki.
Dalton nie tylko opracował pierwszy model atomowy oparty na rygorystycznych eksperymentach. Stworzył także system nomenklatury dla elementów, nakazał je na ich wagę atomową, ustalił prawo wielu proporcji, prawo częściowej presji i opisał ślepotę na pewne kolory, warunek, który sam doznał, nazywał Ślepota kolorów.
Jego obszerny wkład w naukę przyniósł liczne rozróżnienia w całej swojej karierze naukowej, ale Dalton zawsze mieszkał w skromny i prosty sposób, poświęcony nauce do końca swoich dni.
Krótka historia
Od czasu do odległego czasu ludzkość szukała wyjaśnienia na temat natury materii. Greccy myśliciele z V wieku.C, a przed oni niektórzy hinduski filozofowie postulowali, że sprawa została utworzona przez jednostki elementarne zwane atomami. Brakowało im jednak niezbędnego wsparcia eksperymentalnego w celu zweryfikowania ich teorii.
Może ci służyć: jakie są właściwości termiczne i jakie są? (Z przykładami)Pierwszy model atomowy przypisuje się Leucipo i jego Demokrytom uczeń Abdery (460. C. - 370 a. C.). Od pierwszego małego jest znane, ale Demokryt był mędrcem wielkiego znanego, porównywalnego z Platonem i Arystotelesem, chociaż kilka fragmentów jego pracy jest ledwo zachowanych.
Demokryt pomyślał atom jako ostateczną cząsteczkę, która tworzy sprawę, niepodzielną i niezniszczalną. Według ich teorii, cała materia składała się z tych cząstek, zbyt małe, aby można je było zobaczyć. I zgodnie ze sposobem łączenia, atomy zapewniły podmiot ich charakterystyczne właściwości.
W przeciwieństwie do tego, po skomentowaniu. Ciągłe pomysły Arystotelesa w końcu zwyciężyły do początku XIX wieku.
Prace Daltona
W 1793 r. Dzięki jego eksperymentom zdał sobie sprawę, że elementy takie jak.
W 1803 r. Dalton wyjaśnił, że proporcje te wynikają z faktu, że sprawa składa się z podstawowych cząstek, zwanych atomami, jak powiedział Demokrit dawno temu. Przedstawił swoją propozycję w pracy „Nowy system filozofii chemicznej”, w której opisał wyniki swoich eksperymentów.
Ponadto w tej pracy obejmowało również specjalne symbole reprezentujące poszczególne atomy każdego elementu, kładąc w ten sposób fundamenty współczesnej chemii.
Może ci służyć: ostre dźwięki: cechy i przykładyWyjaśnienie modelu atomowego Dalton
W czasach, gdy Dalton rozwinął swoją pracę, inni naukowcy odkryli już niektóre prawa rządzące podmiotem i kombinacje między pierwiastkami: Antoine Lavoisier ustalił, że podczas reakcji chemicznej masa nie jest tworzona ani niszczona, ale staje się to.
Po tym prawie nastąpiło prawo Prousta na temat zdefiniowanych proporcji, ustalając, że gdy dwa elementy są łączone, zawsze robią to w ustalonych proporcjach.
Teraz część eksperymentów Daltona polegała na badaniu wchłaniania wody w wodzie. Tam zauważył, że pewna objętość wody może tylko wchłonąć pewną ilość gazu i że ilość ta różniła się w zależności od gazu. Ponadto gaz można odzyskać z wody, utrzymując nienaruszone właściwości.
Odkrył również, że gdy można połączyć dwa elementy, aby powstać więcej niż jeden związek, ilość każdego pozostaje ustalona i zachowa prostej relacji numerycznej, na przykład 1: 1, 1: 2; 2: 3 i tak dalej. To jest wezwanie Prawo o wielu proporcjach.
Aby wyjaśnić te fakty, Dalton argumentował, że gaz, woda i ogólnie rzecz biorąc, całą materię składa się z podstawowych elementów, które po połączeniu powodują różne związki. Każdy element składa się z charakterystycznych cząstek (Dalton na początku nie nazwał ich atomami), ale nawet w połączeniu, cząstki takie zachowują swoje niezmienione cechy.
Model atomowy Daltona postuluje
Model atomowy Daltona został podsumowany w następujących stwierdzeniach:
1. Materia składa się przez małe niepodzielne cząstki zwane atomami.
2. Każdy element składa się z identycznych atomów ze sobą i o równych właściwościach. Atomy elementu różnią się od attów innych.
3. Łącząc dwa lub więcej atomów różnych elementów, robią to w pewnych i prostych proporcjach, tworząc w ten sposób związki, utworzone przez cząsteczki. Cząsteczki pewnego związku są identyczne z sobą.
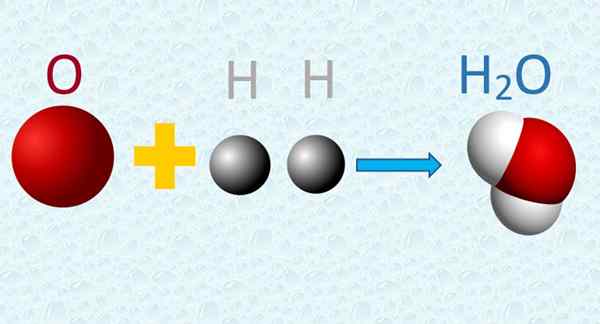 W cząsteczce wody atomy tlenu i wodoru są łączone w prostych proporcjach. Źródło: f. Zapata.
W cząsteczce wody atomy tlenu i wodoru są łączone w prostych proporcjach. Źródło: f. Zapata. 4. Podczas wymiany reakcji chemicznej są wymieniane, ale nie cierpią one żadnej transformacji, ani nie są tworzone ani niszczone w tym procesie.
Niepowodzenia modelu Dalton
Badania naukowe doświadczyły niezwykłego boomu w XIX wieku, promowane przez rewolucję przemysłową. A główne awarie modelu atomowego Daltona nie zostały ujawnione:
Może ci służyć: napięcie międzyfazowe: definicja, równanie, jednostki i pomiar1. Atom nie jest niepodzielny
To jedna z najważniejszych niepowodzeń modelu atomowego Daltona. Eksperymenty przeprowadzone w XIX i XX wieku wykazały, że atom składa się z wielu cząstek subatomowych.
Pierwsze, które się znają, to elektron i proton, a później dowiedzieli się o istnieniu neutronów. Następnie zarówno proton, jak i neutron ujawniły swoją wewnętrzną strukturę.
2. Atomy tego samego elementu mogą nie być identyczne
Elementy mają izotopy, które, chociaż mają te same właściwości chemiczne, różnią się liczbą neutronów, więc ich masa atomowa jest inna. Na przykład izotopy wodoru to proto, deuter i tritium.
3. Atomy nie są niezmienne
Istnieją substancje radioaktywne, które emitują cząstki i energię, przekształcając się w inne elementy.
4. Atomy nie zawsze łączą się w całej proporcje
Udowodniono, że istnieją organiczne, bardziej złożone związki, które nie są zgodne z prawem Daltona o wielu proporcjach.
Artykuły zainteresowane
Model atomowy Schrödingera.
Model atomowy Broglie.
Model atomowy Chadwick.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Dirac Jordan.
Model atomowy Democritus.
Model atomowy Leucipo.
Model atomowy Bohr.
Rutherford Atomic Model.
Obecny model atomowy.

