Obecny model atomowy

- 1770
- 179
- Arkady Sawicki
Jaki jest obecny model atomowy?
On Obecny model atomowy Jest to oparty na mechanice kwantowej, szczególnie w równaniu Schrödingera, zgodnie z zasadą wykluczenia Pauli i właściwości elektronu kręcić się albo Espin.
Jest to model największej akceptacji i zastosowania w badaniu struktury atomów, cząsteczek i reaktywności chemicznej pierwiastków, ze względu na precyzję ich prognoz i ich względnej prostoty.
 Rysunek 1. Atom wodoru w stanie wzbudzonym i jego liczbach atomowych: energia n = 4, pęd kątowy L = 3 i moment magnetyczny M = 1. Źródło: Wikimedia Commons.
Rysunek 1. Atom wodoru w stanie wzbudzonym i jego liczbach atomowych: energia n = 4, pęd kątowy L = 3 i moment magnetyczny M = 1. Źródło: Wikimedia Commons. Ten model jest ewolucją kilku wcześniejszych modeli atomowych, takich jak model Rutherford i ewolu.
Obecnie istnieją teoretycznie bardziej kompletne modele niż model typu Schrödingera, taki jak model Dirac-jordan, który obejmuje specjalną teorię względności i opiera się na równaniu fali Dirac. W tym równaniu spin, właściwość elektronów wymienionych na początku, pojawia się naturalnie.
Istnieją również modele oparte na teorii pola kwantowego, stosowane w fizyce o wysokiej energii. Modele te są doskonałe w przewidywaniu tworzenia i unicestrzenia podstawowych cząstek, celem tej dziedziny fizyki.
Warto wspomnieć, że najbardziej wyrafinowane teorie zbiegają się z takimi samymi wynikami, jak te z równania Schrödingera, szczególnie w przypadku atomów lekkich.
Obecne charakterystyka modelu atomowego
W wizji obecnego atomu, w oparciu o nierelatiwistyczne kwant, nie ma koncepcji orbit elektronicznych w stylu systemów planetarnych.
Jednak najbardziej powszechnym obrazem atomu jest nadal pozytywne jądro centralne i niektóre ujemne kropki ładunku elektrycznego (elektrony), obracając się doskonale zdefiniowane orbity wokół jądra centralnego. Ale pomimo jego korzeni nie odpowiada już obecnego modelu atomowego.
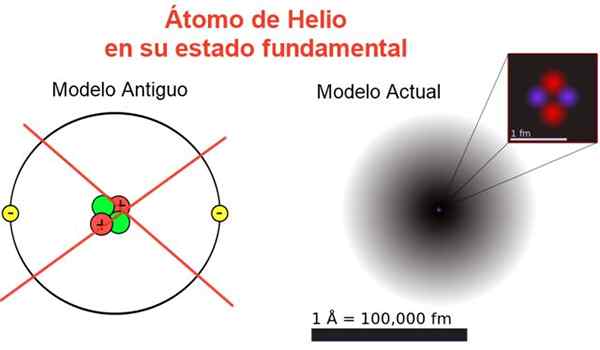 Rysunek 2. Klasyczny i obecny obraz atomu helu w jego podstawowym stanie. W bieżącym modelu dwa elektrony atomu helowego są rozproszone w obszarze zwanym orbitem. Źródło: Wikimedia Commons, twoja własna kompozycja.
Rysunek 2. Klasyczny i obecny obraz atomu helu w jego podstawowym stanie. W bieżącym modelu dwa elektrony atomu helowego są rozproszone w obszarze zwanym orbitem. Źródło: Wikimedia Commons, twoja własna kompozycja. Rysunek 2 pokazuje stary obraz i obecny obraz atomu helu w jego mniejszym stanie energii (poziom n = 1 i l = 0).
Może ci służyć: średnie przyspieszenie: jak jest obliczane i rozwiązaneKlasyczny obraz jest przydatny, aby zobaczyć, że jądro zawiera dwa protony i dwa neutrony. Gwarantując neutralność atomu. Jest dwa elektrony zajmujące ten sam poziom energii.
Od reszty jest to obraz z dala od rzeczywistości, ponieważ skala jądra nie odpowiada nawet skali atomu: jądro jest 1/100000 razy wielkości atomu, ale tam masa atomowa jest zatężona.
Dualizacja Onda - cząstka
Mechanika klasyczna stwierdza, że każda cząstka materiałowa ma powiązaną falę, zwaną Funkcja falowa. To jest słynny Dualizacja cząstki Onda od Louis de Broglie.
W obecnym modelu atomowym zachowanie elektronu w skali atomów jest wyraźnie pofalowane, podczas gdy na poziomie makroskopowym, takie jak elektrony, które poruszają się w rurkach promieniowania katody starych telewizorów, zachowanie korpusowe przeważają.
Z drugiej strony, z fotonami, zdarza się to wręcz przeciwnie, w większości zjawisk optycznych (na poziomie makroskopowym) mają zasadniczo nieznaczne zachowanie. A kiedy wchodzą w interakcje z kwestią materii, mają zachowanie cząstek.
Z tego powodu elektrony wokół jądra są rozproszone na zwane obszary Orbitale atomowe, którego kształt i przedłużenie będą zależeć od poziomu energii elektronów i pędu kątowego.
Zarówno energia, jak i pęd kątowy elektronu wokół jądra mają pewne dozwolone wartości, dlatego mówi się, że są kwantyzowane.
Równanie fali Schrödingera przewiduje, które wartości energii i pęd kątowy są dozwolone, a także funkcja fali związana z każdym poziomem energii i pędu.
Matematyczny kwadrat funkcji fali określa orbitale, to znaczy obszary wokół jądra, w których elektrony można znaleźć bardziej prawdopodobne.
Rozmiar atomu
Aby mieć w skali obraz obecnego modelu atomowego, wyobraźmy sobie, że atom ma średnicę taką jak pola piłki nożnej. Jądro byłaby jak mrówka na środku pola, ale zaskakująco z 99,9% masy atomowej.
Z drugiej strony elektrony byłyby tak rozproszonymi upiornymi graczami na całym polu, z większym prawdopodobieństwem znalezienia w środku pola.
Może ci służyć: zmienna kategorialna: cechy i przykładyIstnieje kilka wyrównania lub pozwala na zajęcie pola, które zależą od energii graczy (elektronów) i ilości „obrotu” lub obrotu wokół środka.
Obecny model atomowy postulaty
1.- Elektron charakteryzuje się masą m, spinem S Oraz jako elementarna cząstka nośnika obciążenia ujemnego (-e).
2.- Elektrony mają podwójne zachowanie w kształcie fali, ale w zależności od ich energii i skali tego zjawiska mogą być bardziej przeważnie jedna niż druga.
3.- Elektrony otaczają dodatnie jądro atomowe, aby gwarantowały neutralność elektryczną atomu. Dlatego ilość elektronów jest równa ilości protonów; To jest Liczba atomowa, To nadaje cechy chemiczne i fizyczne każdego elementu.
4.- Interakcja między elektronami a jądrem jest modelowana przez potencjał V (R) Elektrostatyczny Coulomba, który jest włączony do terminu energia potencjalna w operatorze Hamiltonian.
5.- Termin energii kinetycznej w Hamiltonian Operator jest operatorem zbudowanym z liniowego operatora pędu, który jest taki sam:
P = - i ħ ∂ /∂R
Gdzie ħ jest stałą Plancka podzieloną przez 2π.
6.- Operator Hamiltonian H = (P⋅p)/2m - e v (R) działaj na funkcję fali elektronowej ψ (R).
7.- Gdy poszukiwane są stacjonarne rozwiązania funkcji fali elektronicznej, stosuje się niezależne równanie czasu Schrödingera:
H ψ (R) = E ψ (R)
Gdzie E reprezentuje całkowitą energię elektronu.
8.- W atomach z kilkoma elektronami interakcja między nimi nie jest brana pod uwagę.
9.- Jeśli chodzi o atomy wielu elektronów, orbitale najbardziej zewnętrznych elektronów są modelowane przez potencjał osłoniętego jądra przez najbardziej wewnętrzne elektrony, które jest znane jako potencjał debye.
10.- Równanie (7) ma rozwiązanie dla niektórych dyskretnych wartości energii, tak że celebrytów Ile z Plancka, Naturalnie pojawiają się z rozwiązań równań Schrödingera.
Może ci służyć: fale stacjonarne: wzory, cechy, typy, przykładyjedenaście.- Dla każdej dyskretnej wartości istnieje funkcja falowa. Ale niektóre roztwory są zdegenerowane, w zależności od wartości pędu kątowego l.
12.- Funkcja fali jest iloczynem funkcji promieniowej, funkcji azymutowej i funkcji polarnej.
13.- Ta funkcja fali określa dozwolone regiony elektronów. Kwadrat funkcji fali to gęstości prawdopodobieństwa znaleźć elektron w określonej pozycji, widoczny ze środka jądra atomowego.
14.- Spin nie pojawia się w równaniu Schrödingera, ale jest włączony do modelu atomowego poprzez zasadę Pauli:
Elektron jest fermionem z dwoma możliwymi stanami spin +½ i -½.
Tak więc ten sam stan charakteryzujący się liczbami kwantowymi N, L, M równania Schrödingera, może być najwyżej zajmowany przez 2 elektrony z przeciwieństwami przeciwieństw. W ten sposób ESPIN staje się czwartą liczbą kwantową.
Wpływowi naukowcy w obecnym modelu atomowym
Wydaje się to niesamowite, ale większość fizyków, którzy przyczynili się do obecnego modelu atomowego, pojawia się na tym samym zdjęciu. Zgromadzili się na słynnych konferencjach sponsorowanych przez Ernesta Solvaya, chemika i przemysłowego pochodzenia belgijskiego, który stał się sławny w świecie nauki.
Zaczęli odbywać się od 1911 r. I zgromadzili największych naukowców w tej chwili, wśród nich byli praktycznie wszyscy, którzy wkładali w obecny model atomowy.
Najbardziej znane z tych konferencji odbyło się w Brukseli w 1927 r. I tam zostało zrobione to historyczne zdjęcie:
 Rysunek 3. 1927 Uczestnicy konferencji Solvay w Brukseli. Źródło: Wikimedia Commons.
Rysunek 3. 1927 Uczestnicy konferencji Solvay w Brukseli. Źródło: Wikimedia Commons.  Rysunek 4. Uczestnicy konferencji Solvay 1927.
Rysunek 4. Uczestnicy konferencji Solvay 1927. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Maria Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Donder Théophile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Temile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max urodzony
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels Bohr
- Owen Williams Richardson
Artykuły zainteresowane
Model atomowy Schrödingera.
Model atomowy Broglie.
Model atomowy Chadwick.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Dalton.
Model atomowy Dirac Jordan.
Model atomowy Democritus.
Model atomowy Leucipo.
Model atomowy Bohr.
Bibliografia
- Alonso - Finn. Fundamenty kwantowe i statystyczne. Addison Wesley.
- Bauer, w. 2011. Fizyka inżynierii i nauki. Tom 1. MC Graw Hill.
- Eisberg i Resnick. Fizyka kwantowa. Limusa - Wiley.
- Wikipedia. Teoria atomowa. Odzyskane z: jest.Wikipedia.com
- Zapata f. Typokwutyczny model atomu. Pobrano z: Lifer.com

