Rodzaje miofilamentów, struktura i organizacja
- 3186
- 681
- Pani Gilbert Stolarczyk
Miofilamenty Są to skurczowe białka miofibryli, które są jednostkami strukturalnymi komórek mięśniowych, wydłużonych komórek nazywanych włóknami mięśniowymi.
Włókna mięśniowe i ich komponenty mają określone nazwy. Na przykład błona, cytoplazma, mitochondria i retikulum endoplazmatyczne są znane odpowiednio jako sarcolema, sarkoplasma, sarkosom i retikulum sarkoplazmatyczne.
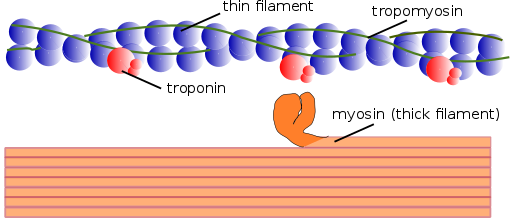
 Struktura miofilamentów (Źródło: Mikael Häggström, używana z dopuszczaniem. [Domena publiczna] za pośrednictwem Wikimedia Commons)
Struktura miofilamentów (Źródło: Mikael Häggström, używana z dopuszczaniem. [Domena publiczna] za pośrednictwem Wikimedia Commons) W ten sam sposób elementy skurczowe w środku są razem nazywane miofibrylami; a białka skurczowe, które składają się na miofibryle, nazywane są miofilamentami.
Istnieją dwa rodzaje miofilamentów: cienkie i grubości. Cienkie włókna składają się głównie z trzech białek: aktyny F, tropomiozyny i troponiny. Tymczasem grube włókna składają się tylko z innego białka znanego jako myosina II.
Oprócz nich istnieją inne białka związane zarówno z grubymi, jak i cienkimi włóknami, ale nie mają one funkcji skurczowych, jeśli nie raczej strukturalnych, wśród których wymienić kilka, tytuł i nebulina.
[TOC]
Rodzaje włókien mięśniowych
Szczególne rozmieszczenie miofilamentów, które stanowią miofibryle, powoduje dwa rodzaje włókien mięśniowych: prążkowane włókna mięśniowe i włókna mięśni gładkich.
Przebite włókna mięśniowe, podczas badania mikroskopu optycznego, pokazują wzór strieryków lub pasm poprzecznych, które są powtarzane wzdłuż całej powierzchni i nadają nazwę, który zawiera je mięśnie, prążkowanego mięśni. Istnieją dwa rodzaje prążkowanych włókien mięśniowych, szkieletowe i sercowe.
Włókna mięśniowe, które nie pokazują, że wzór pasm krzyżowych nazywane są włókienami gładkimi. To oni tworzą muskulaturę ścian naczyniowych i wnętrzności.
Struktura
Cienkie miofilamenty
Te miofilamenty składają się z aktyny F i dwóch powiązanych białek: tropomiozyny i troponiny, które mają funkcje regulacyjne.
Aktyna lub nitkowa aktyna jest polimerem z innego mniejszego białka kulistych zwanego aktyną lub aktyną kulistą o masie cząsteczkowej około 42 kDa. Ma witrynę związkową miozyny i nakazuje się utworzyć dwa łańcuchy ułożone jako podwójny śmigło złożone około 13 monomerów na turę.
Może ci służyć: proteoliza: typy i funkcjeAktyn włókniny charakteryzują się posiadaniem dwóch biegunów: jednego pozytywnego, skierowanego w kierunku dysku z i drugiego negatywnego, ułożonego w kierunku środka Sarcomero.
Tropomiozyna składa się również z podwójnego łańcucha polipeptydowego śmigła. Jest to białko 64 kDa, które tworzy włókna znajdujące się w bruztach pozostawionych przez podwójne łańcuchy śmigła cienkich włókien aktyny F, takie jak „wypełnienie” pustych przestrzeni w śmigłach śmigła.
W spoczynku tropomiozyna obejmuje lub „pokrywka” miejsca aktyny dla miozyny, zapobiegając interakcji obu białek, co powoduje skurczenie mięśni. Wokół każdego cienkiego filamentu i około 25 lub 30ηm od początku każdego tropomiozyny to kolejne białko zwane troponiną.
Troponina (TN) jest kompleksem białkowym złożonym z trzech podjednostek kulistych polipeptydów zwanych troponiną T, C i I. Każda cząsteczka tropomiozyny ma powiązany kompleks troponiny, który ją reguluje, i razem są odpowiedzialne za regulację początku i zakończenie skurczu mięśni.
Grube miofilamenty
Grube włókna to polimery miozyny II, które waży 510 kDa i są tworzone przez dwa ciężkie łańcuchy o pojemności 222 kDa i cztery łańcuchy lekkie. Lekkie łańcuchy są dwóch rodzajów: niezbędne łańcuchy światła, 18 kDa i regulacyjne łańcuchy światła 22 kDa.
Każdy ciężki łańcuch Myosiny II ma kształt laski z małą globularną głową na końcu, która jest przewidywana prawie 90⁰ i ma dwa miejsca ustępujące, jedno dla aktyny i jeden dla ATP. Właśnie dlatego te białka należą do rodziny Atasas.
Gruby filament składa się z ponad 200 cząsteczek miozyny II. Globularna głowa każdej z tych cząsteczek działa jako „wioślarstwo” podczas skurczu, pchając aktynę, z którą jest połączona, aby wślizgnęła się w kierunku środka Sarcomero.
Organizacja
W włóknie mięśni szkieletowych miofibryle zajmują większość sarkoplazmy i są ułożone w zestawach podłużnych i uporządkowanych w całej komórce.
Może ci służyć: mitochondriaW wycięciu podłużnym widocznym za pomocą mikroskopu optycznego, opaski jasne, zwane pasmami i i ciemne pasma, zwane pasmami są obserwowane pasma. Pasma te odpowiadają uporządkowanym usposobieniu miofibryli, a zatem miofilamentów, które je komponują.
Na środku opaski jest ciemna i cienka linia o nazwie linia lub dysk z. Środek każdego pasma A przedstawia wyraźniejszy obszar znany jako zespół H, który jest centralnie podzielony przez ciemniejszą linię o nazwie M Line.
Opisana między dwoma liniami Z, opisano strukturę zwaną sarkomerem, która jest funkcjonalną jednostką mięśnia szkieletowego. Sarcomer składa się z skurczowych miofilamentów ułożonych w pasmach a, h i hemi-pasm I na każdym końcu.
Pasma zawierają tylko cienkie włókna, pasmo zawiera grube włókna przeplatane na ich dwóch końcach z drobnymi włókienami, a pasmo H zawiera tylko grube włókna.
W jaki sposób miofilamenty są zorganizowane w ramach sarkomerów?
Zarówno grube miofilamenty, jak i cienkie miofilamenty można zaobserwować podczas badania próbki mięśni szkieletowych w mikroskopie elektronicznym. Mówi się, że te, które są „współdziałające” lub „przeplatają się” ze sobą w sekwencyjnym, uporządkowanym i równoległym usposobieniu.
Cienkie włókna pochodzą z dysków Z i rozciągają się na każdą stronę w przeciwnym kierunku i w kierunku środka każdego sąsiedniego sarkomeru. Z płyt Z na każdym końcu sari'tomero, w rozluźnione mięsień, aktyna osiąga początek zespołu h z każdej strony.
Zatem we włókna mięśni mięśnia szkieletowego rozluźnione grube miofilamenty zajmują centralny obszar, który tworzy ciemne pasy lub pasy a; A cienkie włókna rozciągają się po obu stronach sarkomenu, nie docierając do środka.
W krzyżowym sekcji w obszarze, w którym grube i cienkie włókna nakładają się, można zaobserwować sześciokątny wzór, który obejmuje grube włókno w środku i sześć cienkich włókien, które go otaczają, i które znajdują się na każdym z krawędzi sześciokątnych sześciokąt.
Może ci służyć: Simplebo: Części i cechyTa organizacja miofilamentów w sarkomor jest zachowana przez funkcję serii białka związanego z miofilamentami i które mają funkcje strukturalne, wśród których można podkreślić tytuł, alfa, nebulinę, miomezę i białko C.
Mechanizm skurczu
Gdy cholina acetylowa (neuroprzekaźnik) jest uwalniana na płycie nerwowo-mięśniowej z powodu stymulacji neuronu ruchowego, włókno mięśniowe jest wzbudzone i otwiera się zależne od napięcia kanały wapniowe.
Wapń wiąże się z troponiną C, a to generuje zmianę konformacyjną tropomiozyny, która odsłania aktywne miejsca, inicjując skurczenie. Gdy poziomy wapnia spadają, tropomiozyna powraca do swojej początkowej pozycji, a skurcz przestaje.
Ekspozycja miejsc związkowych aktyny z miozyną pozwala oba białka dołączyć i że miozyna pchają aktynę w kierunku środka sarkomeru, przesuwając się po miozynie.
Podczas skurczu mięśni linie Z każdego sarcomera zbliżają się do środka, zbliżając się do linii M, zwiększając interdigitację między aktyną a miozyną i zmniejszając wielkość pasm I i H. Stopień skracania będzie zależeć od sumy skrócenia każdego z sarkomenów zakontraktowanego mięśnia.
Bibliografia
- Berne, r., & Levy, m. (1990). Fizjologia. Mosby; Edycja międzynarodowa.
- Fox, s. Siema. (2006). Ludzka psychologia (9 wyd.). Nowy Jork, USA: McGraw-Hill Press.
- Gartner, L., & Hiatt, j. (2002). Histology Atlas Tekst (2 wyd.). Meksyk d.F.: Redaktorzy McGraw-Hill Międzyamerykańscy.
- Murray, r., Bender, d., Botham, k., Kennelly, s. 1., Rodwell, v., I Weil, p. (2009). Ilustrowana biochemia Harpera (28. wyd.). McGraw-Hill Medical.
- Rawn, J. D. (1998). Biochemia. Burlington, Massachusetts: Neil Patterson Publishers.
- Ross, m., & Pawlina, w. (2006). Histologia. Tekst i atlas z skorelowaną biologią komórki i molekularną (Ed.). Lippinott Williams & Wilkins.
- West, J. (1998). Fizjologiczne podstawy praktyki medycznej (12ava ed.). Meksyk d.F.: Pan -american Medical Editorial.
- « Charakterystyka, funkcje i patologie promielocito
- Charakterystyka żyrafy, siedlisko, reprodukcja, jedzenie »

