Grupa metylowa lub metylowa

- 3721
- 844
- Arkady Sawicki
On Grupa metylowa lub metylowa Jest to podstawnik alquiliczny, którego wzorem chemicznym jest Cho3. Jest najprostszy ze wszystkich karbonowanych podstawników w chemii organicznej, ma pojedynczy węgiel i trzy hydrogeny; wywodzi się z gazu metanu. Ponieważ można go połączyć tylko z innym węglem, jego pozycja wskazuje koniec łańcucha, jego zakończenie.
Na poniższym obrazku masz jedną z wielu reprezentacji tej grupy. Sinuossity po twojej prawej stronie wskazują, że za linkiem h3C- może istnieć jakikolwiek atom lub podstawnik; Alkil, R, aromatyczny lub arilo, AR lub heteroátomo lub grupa funkcjonalna, taka jak OH lub CL.
 Grupa metylowa jest najprostszym z opaskowanych podstawników w chemii organicznej. Źródło: su-no-g [domena publiczna]
Grupa metylowa jest najprostszym z opaskowanych podstawników w chemii organicznej. Źródło: su-no-g [domena publiczna] Kiedy grupa funkcjonalna powiązana z metylu jest OH, mamy alkohol metanolu, Cho3Oh; A jeśli jest to CL, będziemy mieć chlorek metylu, Cho3Cl. W nomenklaturze organicznej wymieniono go po prostu jako „metyl” poprzedzona liczbą jej pozycji w najdłuższym łańcuchu węglowym.
Grupa Metilo CH3 Łatwo jest zidentyfikować podczas wyjaśnienia struktur organicznych, szczególnie dzięki spektroskopii jądrowej rezonansu jądrowego 13 (RMN C (RMN C (RMN C13). Po tym po uzyskaniu silnych utleniania grupy kwasu COOH, będąc syntetyczną drogą do syntezy kwasów karboksylowych.
[TOC]
Reprezentacje
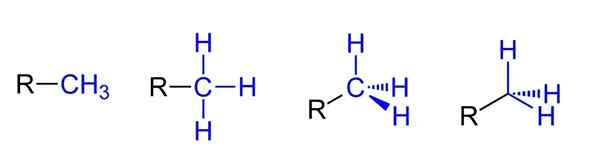 Możliwe reprezentacje dla grupy metylowej. Źródło: Jü przez Wikipedia.
Możliwe reprezentacje dla grupy metylowej. Źródło: Jü przez Wikipedia. Powyżej masz cztery możliwe oświadczenia, zakładając, że Cho3 Jest powiązany z podstawieniem Rico r. Wszystkie są równoważne, ale podczas gdy przestrzenne aspekty cząsteczki przechodzą od lewej do prawej.
Na przykład R-ch3 daje wrażenie, że jest płaski i liniowy. Poniższa reprezentacja pokazuje trzy wiązania kowalencyjne C-H, które pozwalają zidentyfikować metyl w dowolnej strukturze Lewisa i dają fałszywe wrażenie, że bycie krzyżem.
Może ci służyć: jaki jest błąd?Następnie, po prawej (przedostatnim), obserwuje się hybrydyzację SP3 W samochodem Caron3 Ze względu na geometrię czworościenną. W ostatniej reprezentacji chemiczny symbol węgla nie jest nawet napisany, ale utrzymywany jest tetrahedron, aby wskazać, które atomy H są z przodu lub za płaszczyzną.
Chociaż nie ma go na obrazie, kolejny bardzo powtarzający się sposób w momencie reprezentowania cho3 Polega na po prostu umieszczaniu skryptu (-) „nago”. Jest to bardzo przydatne, gdy narysowane są duże szkielety węglowe.
Struktura
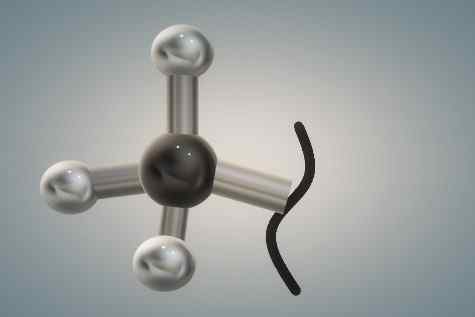 Struktura grupy metylowej reprezentowana przez modelki i pręty. Źródło: Gabriel Bolívar.
Struktura grupy metylowej reprezentowana przez modelki i pręty. Źródło: Gabriel Bolívar. Górny obraz to trzy -wymiarowa reprezentacja pierwszego. Czarna i lśniła kula odpowiada atomowi węglowi, podczas gdy białe są atomami wodoru.
Ponownie, Carbon ma czworościenne produkt hybrydyzacji SP3, I jako taka jest to stosunkowo nieporęczna grupa, z obrotami jej sterycznie zapobieganego łączowi C-R; Oznacza to, że nie może się obrócić, ponieważ białe kule zakłócałyby elektroniczne chmury ich sąsiednich atomów i poczułyby ich odpychanie.
Jednak linki C-H mogą wibrować, podobnie jak link C-R. Dlatego Cho3 Jest to grupa geometrii czworościennej, którą można wyjaśnić (określić, dowiedzieć się) za pomocą spektroskopii promieniowania w podczerwieni (IR), podobnie jak wszystkie grupy funkcjonalne i wiązania węglowe z heteroátomos.
Najważniejsze jest jednak jego wyjaśnienie poprzez NMR13. Dzięki tej technice określono względną ilość grup metylowych, co pozwala na składanie struktury molekularnej.
Może ci służyć: cenne rozwiązaniaOgólnie rzecz biorąc, tym więcej grup cha3 Mieć cząsteczkę, bardziej „niezdarne” lub nieefektywne będą jej interakcjami międzycząsteczkowymi; to znaczy, nieletni będą jego stopami topnienia i wrzenia. Grupy Ch3, Ze względu na swoje hydrogeny „poślizgają się” ze sobą, gdy zbliżają się lub dotykają.
Nieruchomości
Grupa metylowa charakteryzuje się jako hydrofobowy i apolowy.
Wynika to z faktu, że ich wiązania C-H nie są bardzo polarne ze względu na niską różnicę między elektroonetywicznością węgla i wodoru; A ponadto jego czworościenna i symetryczna geometria niemal jednorodnie rozkłada jej gęstość elektroniczną, co przyczynia się do nikczemnego momentu dipolowego.
Przy braku polaryzacji, Cho3 „Woda” wody, zachowująca się jak hydrofobowy. Dlatego, jeśli zostanie to widoczne w cząsteczce, będzie wiadomo, że ten koniec metylu nie będzie skutecznie oddziaływać z wodą lub innym rozpuszczalnikiem polarnym.
Kolejna cecha CH3 To twoja względna stabilność. O ile atom, który jest z nim powiązany z odstawieniem gęstości elektronicznej, pozostaje praktycznie obojętna przed bardzo silnymi kwaśnymi środkami. Okaże się jednak, że może uczestniczyć w reakcjach chemicznych, głównie w jego utlenianiu lub migracji (metylacji) do innej cząsteczki.
Reaktywność
Utlenianie
Ch3 nie jest zwolniony z utleniania. Oznacza to, że jest podatny na tworzenie linków z tlenem, C-O, jeśli reaguje z silnymi środkami utleniającymi. Ponieważ utlenia się, staje się różnymi grupami funkcjonalnymi.
Na przykład jego pierwsze utlenianie powoduje powstanie grupy Metiolu (lub hydroksymetylu), CHO2Och, alkohol. Drugi, pochodzi w grupie Formil, Cho (HC = O), aldehyd. I trzeci finał.
Może ci służyć: stała jonizacjiTa seria utleniania służy do syntezy kwasu benzoesowego (HOOC-C6H5) Z Toluen (H3DC6H5).
Jony
Ch3 Podczas mechanizmu niektórych reakcji możesz wygrać chwilowe obciążenia elektryczne. Na przykład, gdy metanol jest ogrzewany w bardzo silnym pożywce kwasowej, w teoretycznym braku nukleofilów (wyszukiwarki obciążenia dodatniego), powstaje kation metaliczny3+, Ponieważ łącze CHO jest zepsute3-Och i och, wychodzi z parą elektronów wiązania.
Gatunek Ch3+ Jest tak reaktywny, że można go było określić tylko w fazie gazowej, ponieważ reaguje lub znika na najmniejszą obecność nukleofilu.
Z drugiej strony Cho3 Anion można również uzyskać: Metanuro, CH3-, Najprostszy karbanion ze wszystkich. Jednak jak Cho3+, Jego obecność jest nienormalna i odbywa się tylko w ekstremalnych warunkach.
Reakcja metylacji
W reakcji metylacji CH jest przenoszony3 do cząsteczki bez ładunków elektrycznych (Cho3+ ani ch3-) w trakcie. Na przykład jodek metylu, Cho3I, jest dobrym środkiem metryntowym i może zastąpić łącznik O-H kilku cząsteczek jednym O-ch3.
W syntezie organicznej nie pociąga to za sobą żadnej tragedii; Ale kiedy nadmiernie metylowe są podstawy azotu DNA.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- Rahul Gladwin. (23 listopada 2018 r.). Metylacja. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Danielle Reid. (2019). Grupa metylowa: struktura i formuła. Badanie. Odzyskane z: Study.com
- Wikipedia. (2019). Grupa metylowa. Źródło: w:.Wikipedia.org
- « ENEGON WŁAŚCIWE, JAK ZROBIĆ ENEGON, Przykłady
- Koncepcja i wzór objętości molowej, obliczenia i przykłady »

