Metale alkaliczne
- 4148
- 340
- Pani Gilbert Stolarczyk
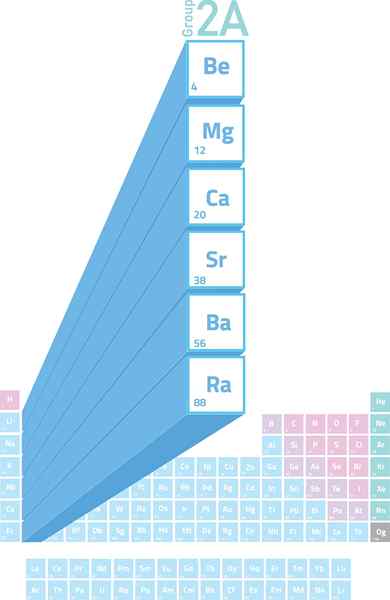
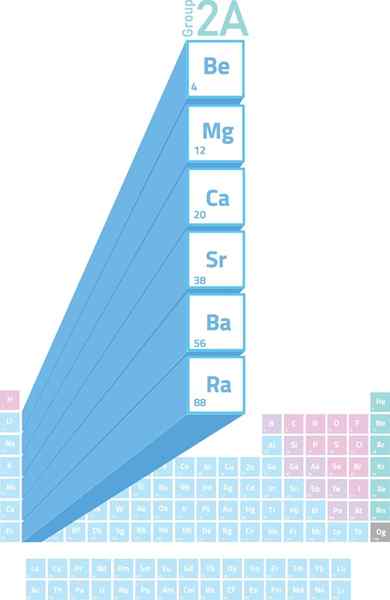 Lokalizacja metali alkalicznych w tabeli okresowej
Lokalizacja metali alkalicznych w tabeli okresowej Co to są metale alkaliczne?
Metale alkaliczne Są to elementy grupy 2 (wcześniej nazywane grupą 2a) z okazji stolika okresowego. To znaczy, że są one utworzone przez 6 elementów drugiej kolumny okresowej tabeli, od berylu (be) do radia (RA).
Są grupą dość reaktywnych i stosunkowo powszechnych metalowych elementów. Mają tylko dwa elektrony walencyjne zlokalizowane na orbicie S. Z tego powodu należą one do bloku S tabeli okresowej.
Nazwa „Alkalinoterreo” pochodzi od zjednoczenia słów „alkalicznych”, które jest innym sposobem powiedzenia podstawowego, i ziemi, tak powiedziano im przed tlenkami. Tak więc metale alkaliczne dosłownie oznaczają metale, które tworzą podstawowe tlenki.
Te metale mają wiele zastosowań, które czynią je ważnymi w naszym obecnym społeczeństwie, zwłaszcza magnezu. Te aplikacje są spowodowane ich konkretnymi właściwościami, które opisano poniżej.
Właściwości metali alkalicznych
Mają metalowy wygląd
Wszystkie metale alkaliczne mają srebrny kolor z metaliczną jasnością. Radon jest również radioaktywny, więc świeci w ciemności, emitując charakterystyczne zielone światło.
Są to małe gęste metale
Wszystkie metale alkaliczne są gęstsze niż woda, ale są mniej gęste niż większość innych elementów metalowych w stole okresowym.
Gęstości w tej grupie wahają się od 1,54 g/cm3 Dla wapnia do 5,5 g/cm3 Dla radia, które jest znacznie mniejsze niż gęstość innych metali, takich jak żelazo (7,9 g/cm3), miedź (9,0 g/cm3), ołów (11,3 g/cm3) i El Mercurio (13,5 g/cm3), aby wymienić tylko kilka.
Mają stosunkowo niskie punkty topnienia i wrzenia
Będąc metali, jego temperatury topnienia i wrzenia są większe niż w większości nieMetali. Są jednak niższe niż temperatura fuzji i wrzenia większości innych metali, z pewnymi wyjątkami.
Może ci służyć: równanie ArrheniusaMają Walencję +2
Ze względu na konfigurację elektroniczną metale te zwykle tracą dwa elektron. Z tego powodu jego jedyna Walencja to +2.
Są stosunkowo reaktywne
Metale alkaliczne są znacznie bardziej reaktywne niż metale, takie jak żelazo lub miedź, ale są mniej reaktywne niż metale alkaliczne (elementy grupy 1). Im niższa grupa, tym bardziej reaktywny jest metal.
Na przykład berylu (pierwsza grupa) nie reaguje z wodą, podczas gdy dwa następujące mogą reagować z gorącą wodą, a ostatnie mogą nawet reagować z zimną wodą.
Reaguj z powietrzem, tworząc podstawowe tlenki
Te metale mają tendencję do tworzenia podstawowych tlenków, gdy reagują z tlenem powietrza. W rzeczywistości dlatego nazywane są alkaliniami. Te tlenki, po rozpuszczaniu się w wodzie, stają się wodorotlenkami, które wytwarzają roztwory alkaliczne lub podstawowe.
Zastosowania metali alkalicznych
W branży technologicznej
Niektóre metale alkaliczne są stosowane w produkcji półprzewodników. Są one niezbędne w budowie obwodów elektronicznych, takich jak te, które zawierają praktycznie wszystkie nowoczesne urządzenia elektryczne, od komputerów i telefonów komórkowych, po pralki, samochody i inne.
W branży spożywczej
Wapń jest niezbędnym składnikiem odżywczym na całe życie. Jest częścią struktury kości i ma inne ważne funkcje w ciele. Z tego powodu ten element jest dodawany jako umocnik do wielu żywności od zbóż po produkty mleczne. Ponadto jest również stosowany w produkcji serów.
Może ci służyć: okrągW branży samochodowej
Niektóre metale alkaliczne mają bardzo dobre właściwości mechaniczne, co oznacza, że są twarde i odporne. Ponadto są odporne na korozję, więc są często stosowane w produkcji luksusowych kół do samochodów, a także innych części.
W przemyśle wojskowym
Ze względu na ich właściwości mechaniczne i niską gęstość metale, takie jak magnez i beryl, są stosowane w budowie samolotów bojowych, satelitów i helikopterów.
Ponadto, ze względu na ich właściwości elektryczne, są one również używane do produkcji różnych rodzajów czujników oraz systemów optycznych i elektronicznych, których przemysł wojskowy używa do tworzenia broni i systemów komunikacyjnych.
Sześć metali alkalicznych
Istnieje tylko sześć metali alkalicznych. Następnie istnieje krótki opis każdego z nich:
Berylum (be)
Jest to element numer 4 tabeli okresowej i pierwszego z grupy metali alkalicznych. Jest to bardzo lekki, mocny metal z unikalnymi właściwościami, które sprawiają, że jest użyteczny w produkcji półprzewodników.
Magnez (mg)
Magnez jest stosunkowo lekkim srebrnym metalem o niskiej temperaturze topnienia i wrzenia (w porównaniu z innymi metali). Jest bardzo twardy i odporny i jest często stosowany w produkcji części samochodowych i jako dodatek do przygotowania stopów, takich jak niektóre rodzaje stali.
Jest to drugi alkaliczny metal i element numer 12 stolika okresowego. Podobnie jak inne elementy w tej grupie, jest to niezbędny składnik odżywczy na całe życie.
Wapń (CA)
Wapń jest 5. najliczniejszym elementem w krze Ziemi. Stwierdzono go jako węglan wapnia w wielu minerałach i skałach, a także jest niezbędnym elementem życia ze względu na jego udział w tworzeniu kości i jego znaczeniu w układzie nerwowym.
Może ci służyć: chlorek strontu (SRCL2)Ten metal jest elementem numer 20 stolika okresowego, jest w czwartym okresie i jest trzecim alkalicznym metalem.
Stront (sr)
Element numer 38 i czwarty metal alkaliczny to stront. Jest cięższy niż wapń, ale wydaje się wiele pod względem właściwości chemicznych i fizycznych. W rzeczywistości stront może zastąpić wapń w kościach.
Jest to szczególnie problematyczne, gdy narażamy się na radioaktywne stronium, które występuje po reakcji jądrowej, ponieważ przy przestrzeganiu kości bardzo trudno jest wyeliminować z organizmu i zatruwa nas promieniowaniem małym przez nieco przez niewielki sposób.
Bar (BA)
Ten element ma liczbę atomową 56, a także właściwości dość podobne do właściwości wapnia i strontu. Jest to raczej miękki i bardzo reaktywny metal, który nie ma natury elementarnej. Jest to jeden z metali alkalicznych o większym charakterze metalicznym.
Radio (RA)
Ostatnim elementem grupy Alcalinoterreos jest radio, radioaktywny metal (stąd jego nazwa), który emituje słabe zielone światło, które jest łatwe do zaobserwowania w ciemności.
Kiedyś był często używany w przygotowaniu obrazów, które świecą w ciemności, ale po odkryciu niebezpieczeństwa zdrowia jego użycie było zabronione.

