Formuły i jednostki prawa Charlesa, eksperymenty, ćwiczenia

- 1447
- 214
- Herbert Wróblewski
Charles Law lub Guy-Lussac to taki, który umożliwia stwierdzenie jednej z właściwości stanu gazowego: objętość zajmująca gaz jest wprost proporcjonalny do temperatury przy stałym ciśnieniu.
Ta proporcjonalność jest liniowa dla wszystkich zakresów temperatur, jeśli dany gaz jest idealny; Z drugiej strony gazy królewskie odbiegają od trendu liniowego w temperaturach w pobliżu ich punktu kondensacji. Nie ograniczało to jednak wykorzystania tego prawa do niekończących się zastosowań, w których biorą udział.
 Chińskie latarnie lub życzenia. Źródło: Pxhere.
Chińskie latarnie lub życzenia. Źródło: Pxhere. Jednym z par doskonałości prawa Karola jest obecność w balonach aerodynamicznych. Inne prostsze balony, takie jak pragnienia, zwane także chińską lampą.
Dlaczego stałe ciśnienie? Ponieważ jeśli ciśnienie wzrosło, oznaczałoby to, że pojemnik, w którym gaz jest umieszczony, jest szczelnie zamknięty; I dzięki temu zderzenia lub skutki cząstek gazowych na wewnętrzne ściany wspomnianego pojemnika (prawo Boyle-Maleotte) zwiększyłyby zderzenia lub skutki wewnętrznych cząstek (prawo Boyle-Maleotte).
Dlatego nie byłoby zmiany wolumenu zajmowanego przez gaz, a prawo Karola nie byłoby rygorystyczne. W przeciwieństwie do hermetycznego pojemnika, tkanka balonów pragnień stanowi barierę mobilną, zdolną do rozszerzenia lub kurczenia się w zależności od ciśnienia wywieranego przez gaz wewnątrz.
Jednak gdy tkanka balonowa się rozszerza, ciśnienie wewnętrzne gazu pozostaje stałe, ponieważ zwiększa obszar, nad którym zderzają się cząsteczki. Im wyższa temperatura gazu, tym większa energia kinetyczna cząstek, a zatem liczba zderzeń.
A kiedy glob rozszerza się ponownie, kolizje z wewnętrznymi ścianami pozostają stałe (najlepiej).
Im gorętszy jest gaz, tym większa ekspansja globu i tym bardziej wzrośnie. Rezultat: czerwone (choć niebezpieczne) światła zawieszone na niebie w grudniu.
[TOC]
Jakie jest prawo Karola?
Oświadczenie
Tak zwane prawo Charlesa lub prawo gejów-Lussaca wyjaśnia zależność między objętością zajmowaną przez gaz a wartością jego bezwzględnej temperatury lub temperatury Kelvina.
Prawo można wydać w następujący sposób: Jeśli ciśnienie pozostaje stałe, spełnia się, że „dla danej masy gazu zwiększa jego objętość o 1/273 razy w przybliżeniu jego objętość do 0 ° ) To zwiększa jego temperaturę ”.
Oferty pracy
Prace badawcze, które pozwoliły na ustanowienie prawa, zostały zainicjowane w latach 80. XIX wieku przez Jacquesa Alexandra Cesara Charlesa (1746–1823). Jednak Charles nie opublikował wyników swoich dochodzeń.
Następnie John Dalton w 1801 r. Wyniki te zostały potwierdzone przez gay-lussac w 1802 roku.
Prace badawcze Charlesa, Daltona i Gay-Lussaca pozwoliły ustalić, że objętość zajmowana przez gaz i jego temperaturę bezwzględną są bezpośrednio proporcjonalne. Dlatego istnieje liniowa zależność między temperaturą a objętością gazu.
Może ci służyć: metody rozdziału heterogenicznych mieszaninWykres
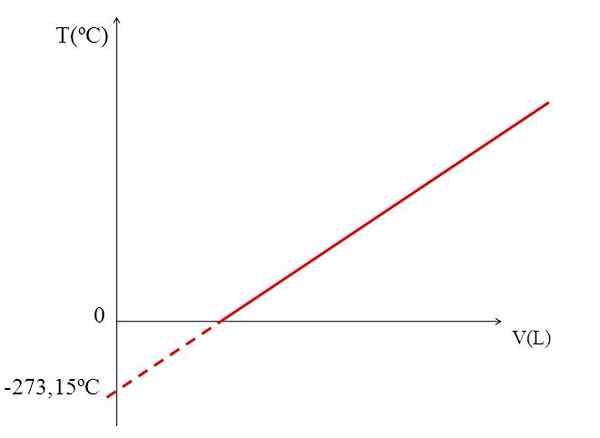 T vs v wykres dla gazu idealnego. Źródło: Gabriel Bolívar.
T vs v wykres dla gazu idealnego. Źródło: Gabriel Bolívar. Realizacja wykresu (górnego obrazu) objętości gazu w stosunku do temperatury wytwarza linię prostą. Przecięcie linii z osą x, w temperaturze 0 ° C, pozwala uzyskać objętość gazu w 0 ° C.
Podobnie, przecięcie linii z osą x, dałoby informacje o temperaturze, dla której objętość zajmowana przez gaz wynosiłaby zero „0”. Dalton oszacował tę wartość na -266 ° C, blisko wartości sugerowanej przez Kelvina dla bezwzględnego (0) bezwzględnego.
Kelvin zaproponował skalę temperatury, której zero powinno być temperaturą, w której idealny gaz miałby objętość zero. Ale w tych niskich temperaturach gazy są upłynnione.
Dlatego nie możemy mówić o objętościach gazów jako takich, stwierdzając, że wartość dla bezwzględnego zera powinna wynosić -273,15 ºC.
Formuły i jednostki pomiarowe
Formuły
Prawo Charlesa w nowoczesnej wersji wskazuje, że objętość i temperatura gazu są bezpośrednio proporcjonalne.
Więc:
V / t = k
V = objętość gazu. T = temperatura Kelvina (K). K = stała proporcjonalności.
Dla tomu V1 i temperatura t1
k = v1 / T1
Również dla tomu V2 i temperatura t2
k = v2 / T2
Następnie, dopasowując dwa równania dla k
V1 / T1 = V2 / T2
Ta formuła można zapisać w następujący sposób:
V1 · T2 = V2 · T1
Oczyszczanie v2, Formuła jest uzyskiwana:
V2 = V1 · T2 / T1
Jednostki
Objętość gazu można wyrażać w litrach lub w dowolnej z jego pochodnych jednostek. Podobnie objętość może być wyrażona w metrach sześciennych lub w dowolnej pochodnej jednostce. Temperatura musi być wyrażona w temperaturze bezwzględnej lub temperaturze Kelvina.
Tak więc, jeśli temperatury gazu są wyrażone w skali Celsjusza lub Celsjusza, aby wykonać z nimi obliczenia, do temperatur należy dodać ilość 273,15 ° C.
Jeśli temperatury są wyrażone w stopniach Farenheita, należy go dodać do tych temperatur 459,67 °.
Kolejna znana formuła prawa Karola i bezpośrednio związana z jego stwierdzeniem, jest następująca:
VT = Valbo (1 + T/273)
Gdzie vT Jest to objętość zajmowana przez gaz w określonej temperaturze, wyrażony w litrach, cm3, itp.; i valbo Jest to objętość zajmowana przez gaz w temperaturze 0 ° C. Ze swojej części T jest temperaturą, w której wykonuje się pomiar objętościowy, wyrażany w stopniach Celsjusza (ºC) (ºC).
I wreszcie 273 reprezentuje bezwzględną wartość zerową w skali temperatury Kelvina.
Eksperyment, aby zademonstrować prawo
Montowanie
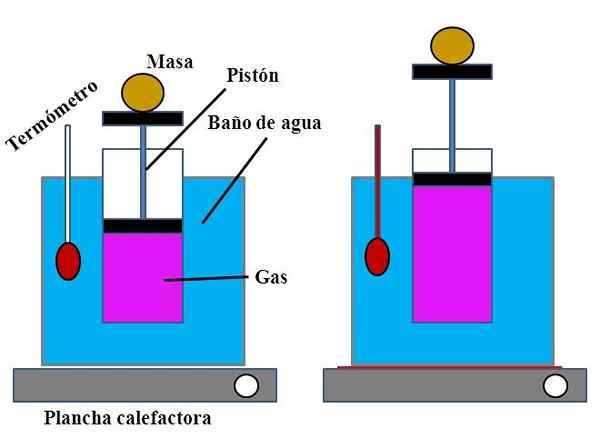 Zgromadzenie eksperymentu w celu wykazania prawa Karola. Źródło: Gabriel Bolívar.
Zgromadzenie eksperymentu w celu wykazania prawa Karola. Źródło: Gabriel Bolívar. W pojemniku wodnym, który spełnił funkcję kąpieli wodnej, otwartym cylindrem umieszczono w górnej części, z tłokiem, który dostosował się do wewnętrznej ściany cylindra (obraz najwyższy).
Ten tłok (utworzony przez tłok i dwie czarne zasady) może przesunąć się do górnej lub dolnej części cylindra w zależności od objętości zawartego gazu.
Kąpiel wodna można ogrzewać za pomocą lżejszej lub ogrzewania, która zapewniła ciepło niezbędne do zwiększenia temperatury łazienki, a zatem temperaturę cylindra wyposażonego w tłok.
Może ci służyć: wodorotlenek wapnia (CA (OH) 2): Struktura, właściwości, uzyskiwanie, zastosowaniaNa tłoku umieszczono pewną masę, aby zapewnić, że eksperyment został przeprowadzony pod stałym ciśnieniem. Temperatura łazienki i cylindra mierzono za pomocą termometru umieszczonego w kąpieli wodnej.
Chociaż prawdopodobnie cylinder nie miał ukończenia ukończenia objętości powietrza, można to oszacować, mierząc wysokość, jaką masę umieszczoną na tłonie i powierzchnię podstawy cylindra.
Rozwój
Objętość cylindra jest uzyskiwana przez pomnożenie powierzchni jej podstawy przez wysokość. Powierzchnię podstawy cylindra można uzyskać przez zastosowanie wzoru: s = pi x r2.
Podczas gdy wysokość jest uzyskiwana przez pomiar odległości od podstawy cylindra, do tłoka, na którym spoczywa ciasto.
Gdy temperatura łazienki wzrosła przez ciepło wytwarzane przez zapalnice, zaobserwowano, że tłok wzniósł się w cylindrze. Następnie odczytują temperaturę w łaźni wodnej w termometrze, który odpowiadał wnętrzu cylindra.
Mierzą również wysokość ciasta na tłoku, będąc w stanie oszacować objętość powietrza, która odpowiadała zmierzonej temperaturze. W ten sposób dokonali kilku pomiarów temperatury i oszacowań objętości powietrza odpowiadających każdej temperaturze.
Może to w końcu ustalić, że objętość zajmowana przez gaz jest bezpośrednio proporcjonalny do jego temperatury. Ten wniosek pozwolił na podanie SO -Called Charles Law.
Globo z lodem zimą
Oprócz poprzedniego eksperymentu istnieje prostszy i bardziej jakościowy: balon z lodem zimą.
Jeśli zimą umieszczono balon pełen helu w pomieszczeniu z ogrzewaniem, glob miałby określoną objętość; Ale, gdyby następnie przeniesiono na zewnątrz domu o niskiej temperaturze, zaobserwowano, że balon helowy kurczy się, zmniejszając jego objętość zgodnie z prawem Charlesa.
Rozwiązane ćwiczenia
Ćwiczenie 1
Masz gaz, który zajmuje objętość 750 cm3 w 25 °?
Konieczne jest najpierw przekształcenie jednostek temperaturowych w Kelvin:
T1 W stopniach Kelvin = 25 ºC + 273,15 ºC = 298,15 K
T2 W stopniach Kelvin = 37 ºC + 273,15 ºC = 310,15 K
Ponieważ jest znane v1 i inne zmienne, usuwa v2 I jest obliczane za pomocą następującego równania:
V2 = V1 · (T2 / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Ćwiczenie 2
Jaka byłaby temperatura w stopniach Celsjusza, do której 3 litrów gazu powinny być ogrzewane do 32 ° C, aby jego objętość rozszerza się do 3,2 litra?
Znowu stopnie Celsjusza w Kelvin są przekształcane:
T1 = 32 ºC + 273,15 ºC = 305,15 K
I jak w poprzednim ćwiczeniu, t jest oczyszczane2 Zamiast v2, a następnie oblicza:
T2 = V2 · (T1 / V1)
= 3,2 l · (305,15 k / 3 l)
= 325,49 k
Ale stwierdzenie prosi o stopnie Celsjusza, więc jednostka T jest zmieniona2:
T2 W stopniach celsjusza = 325, 49 ° C (k) - 273,15 ºC (k)
Może ci służyć: strzykawka Pascal= 52,34 ºC
Ćwiczenie 3
Jeśli gaz w temperaturze 0 ° C zajmuje objętość 50 cm3, Jaki objętość będzie zajmować 45 ° C?
Korzystanie z oryginalnej formuły prawa Karola:
VT = Valbo (1 + T /273)
Przejdź do obliczenia vT bezpośrednio, gdy pozbywasz się wszystkich zmiennych:
VT = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (k))
= 58,24 cm3
Z drugiej strony, jeśli problem zostanie rozwiązany przy użyciu strategii przykładów 1 i 2, będziemy mieli:
V2 = V1 · (T2 / T1)
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
Wynik, stosowanie tych dwóch procedur, jest taki sam, ponieważ ostatecznie są one oparte na tej samej zasadzie prawa Karola.
Aplikacje
Wishe Galls
Balony życzeń (już wspomniane we wstępie) są wyposażone w materiał tekstylny zaimpregnowany palącej płynem.
Kiedy pożar wystrzeliwuje ten materiał, istnieje wzrost temperatury powietrza zawarty na świecie, co powoduje wzrost objętości gazu według prawa Charlesa.
Dlatego, zwiększając objętość powietrza na świecie, gęstość powietrza maleje w nim, co jest mniej niż gęstość otaczającego powietrza, i dlatego glob wkracza.
Wyskakujące termometry lub indyki
Jak wskazuje jego nazwa, są używane podczas gotowania indyków. Termometr ma pojemnik pełen zamkniętego powietrza z pokrywką i jest skalibrowany w taki sposób, że po osiągnięciu optymalnej temperatury gotowania pokrywka jest podnoszona przez emitując dźwięk.
Termometr jest umieszczony wewnątrz indyka, a wraz ze wzrostem temperatury w piekarniku powietrze wewnątrz termometru. Więc kiedy objętość powietrza osiągnie określoną wartość, powoduje podnoszenie termometru.
Odzyskanie formy piłek ping-ponga
Kulki ping-ponga w zależności od wymagań ich użycia, są lekkie, a ich ściany tworzyw sztucznych są niewiele grube. To sprawia, że wpływ rakiety cierpią.
Umieszczając zdeformowane kulki w gorącej wodzie, powietrze w środku jest podgrzewane i występuje jego rozszerzenie, co prowadzi do wzrostu objętości powietrza. Powoduje to również odcinek ściany piłek ping-ponga, co pozwala na odzyskanie jej oryginalnej formy.
Opracowanie Paes
Drożdże są włączone do mąki pszennej, która służy do wytwarzania chleba i mają zdolność do wytwarzania gazu dwutlenku węgla.
Zwiększając temperaturę chleba podczas gotowania, objętość dwutlenku węgla wzrasta. Z tego powodu rozszerzenie chleba występuje do momentu osiągnięcia pożądanej objętości.
Bibliografia
- Clark J. (2013). Przepisy dotyczące gazu oter - prawo Boyle'a i prawo Karola. Odzyskane z: chemguide.współ.Wielka Brytania
- Staroscik Andrew. (2018). Prawo Karola. Pobrano z: Scienprimer.com
- Wikipedia. (2019). Charles Law. Źródło: w:.Wikipedia.org
- Helmestine, Todd. (27 grudnia 2018 r.). Jaka jest formuła prawa Karola? Odzyskane z: Thoughtco.com
- Prof. N. Lwa. (S.F.). Podstawowe przepisy dotyczące gazu: Charles Law. C 101 Uwagi klasowe. Odzyskany z: iun.Edu
- Briceño Gabriela. (2018). Charles Law. Odzyskane z: Euston96.com
- Morris, J. G. (1974). Fizykochemia biologów. (2daje wydanie). Redakcja Reverté, S.DO.
- « Czternaście punktów w tle Wilsona i to, jak wpłynęło to na Niemcy
- Zastosowania pojęć energii, mocy, siły, pracy »

