Funkcje LDH, określenie, reakcja, wartości normalne
- 3383
- 403
- Matylda Duda
Dehydrogenaza mleczanowa, Dehydrogenaza kwasu mlekowego, zależna od mleczanu NAD lub po prostu LDH, jest enzymem należącym do grupy oksydortyki, która występuje praktycznie we wszystkich tkankach zwierzęcych, warzywach i wielu mikroorganizmach, takich jak bakterie, drożdże i łuki.
Enzymy tego typu są oznaczone liczbą EC 1.1.1.27 enzymatycznej komitetu nomenklatury i są odpowiedzialne za reakcję, która przekształca mleczan na pirogronian (przez utlenianie) i odwrotnie (przez redukcję), utlenianie lub zmniejszanie dyukleotydów nikotynamidu adeniny (NAD+ i NADH) w procesie znanym jako fermentacja mleka.
 Struktura krystaliczna dehydrogenazy mleczanowej B (źródło: BCDOYE [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons)
Struktura krystaliczna dehydrogenazy mleczanowej B (źródło: BCDOYE [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons) W przeciwieństwie do fermentacji alkoholowej, która występuje tylko w niektórych mikroorganizmach, takich jak drożdże i użycie.
Ten ważny enzym dla metabolizmu komórkowego krystalizowano z mięśni szkieletowych szczurów w latach 40. XX wieku, a do tej pory najlepiej scharakteryzować mięśnie szkieletowe i tkankę serca u ssaków.
U „wyższych” zwierząt enzym wykorzystuje izomer Latynianu (L-mleczan) do wytwarzania pirogronianu, ale niektóre „niższe” zwierzęta i bakterie wytwarzają D-mleczan z pirogronianu uzyskanego przez glikolizę.
Dehydrogenaza mleczanowa jest zwykle wyrażana głównie w tkankach lub komórkach w warunkach beztlenowych (niskie nawadnianie krwi), że na przykład u ludzi może scharakteryzować warunki patologiczne, takie jak rak, wątroba lub serca.
Jednak konwersja pirogronianu na mleczan jest typowy dla mięśni podczas ćwiczeń i rogówki oka, które jest słabo utlenione.
[TOC]
Funkcje
Dehydrogenaza mleczanowa spełnia wiele funkcji na wielu trasach metabolicznych. Jest to centrum delikatnej równowagi między katabolicznymi i anabolicznymi trasami węglowodanów.
Podczas glikolizy aerobowej pirogronian (ostatni produkt trasy jako taki) Może być stosowany jako substrat z kompleksu enzymatycznej dehydrogenazy pirogronianowej, przez którą jest dekarboksylowana, uwalniając cząsteczki acetylo-CoA, które są stosowane w dół, metabolicznie, w cyklu Krebsa w cyklu Krebsa.
Przeciwnie, w beztlenowej glikolizy, ostatni etap glikolizy wytwarza pirogronian, ale jest to stosowane przez dehydrogenazę mleczanową do wytwarzania mleczanu i NAD+, który przywraca NAD+ który zastosowano podczas reakcji katalizowanej przez dehydrogenazę 3-fosforanu gliceraldehydowego.
Podobnie jak podczas anaerobiozy, głównym źródłem produkcji energii w postaci ATP jest glikoliza, dehydrogenaza mleczanowa odgrywa fundamentalną rolę w ponownej utlenianiu NADH wytwarzanego na poprzednich etapach drogi glikolitycznej, niezbędne do działania innych powiązanych enzymów.
Może ci służyć: tubulinDehydrogenaza mleczanowa bierze również udział w glikogenezie, która ma miejsce w tkankach, które przekształcają mleczan w glikogen i, w niektórych tkankach aerobowych, takich jak serce, mleczan jest paliwem, które jest ponownie pokażane w celu wytwarzania energii i zmniejszenia mocy w postaci ATP i NAD+, odpowiednio.
Charakterystyka i struktura
Istnieje wiele molekularnych postaci dehydrogenazy mleczanowej w naturze. Tylko u zwierząt ustalono, że istnieje pięć aktywności dehydrogenazy mleczanowej, wszystkie tetrameryczne i zasadniczo składające się z dwóch rodzajów łańcuchów polipeptydowych zwanych podjednostkami H i M (możliwość bycia homo- lub heterotramérica).
Forma H jest zazwyczaj w tkaninie serca, podczas gdy forma M została wykryta w mięśniach szkieletowych. Oba łańcuchy różnią się od siebie pod względem obfitości, składu aminokwasów, właściwości kinetycznych i właściwości strukturalnych.
Formy H i M są produktem translacyjnym różnych genów, prawdopodobnie znajdujących się w różnych chromosomach, które są również pod kontrolą lub regulacją różnych genów. Forma H ma dominującą w tkankach z metabolizmem aerobowym i postacią M w tkankach beztlenowych.
Inny rodzaj nomenklatury wykorzystuje litery A, B i C dla różnych rodzajów enzymów zarówno u ssaków, jak i ptaków. Zatem dehydrogenaza mięśni mleczanowych jest znana jako4, Cardiac as b4 a trzecia nazywa się C4, co jest specyficzne dla jąder.
Ekspresja tych izoenzymów jest regulowana zarówno w postaci zależnej od rozwoju, jak i zależności od tkanki.
Enzym został wyizolowany z różnych źródeł zwierząt i ustalono, że jego tetrameryczna struktura ma średnią masę cząsteczkową około 140 kDa i że miejsce Unii dla NADH lub NAD+ Składa się z arkusza β-peelowanego złożonego z sześciu łańcuchów i 4 śmigieł alfa.
Determinacja
Za pomocą spektrofotometrii
Aktywność mleczanu dehydrogenaza pochodzenia zwierzęcia jest pewna spektrofotometrycznie In vitro Poprzez pomiary zmiany zabarwienia dzięki procesie utleniania, który zachodzi podczas reakcji konwersji pirogronianu mleczanu.
Pomiary wykonuje się przy 340 nm ze spektrofotometrem i określono szybkość spadku gęstości optycznej z powodu utleniania lub „zniknięcia” NADH, która jest przekształcana w NAD+.
Oznacza to, że określona reakcja jest następująca:
Pirogronian + NADH + H+ → mleczan + NAD+
Pomiar enzymatyczny powinien być przeprowadzany w optymalnych warunkach pH i stężenie substratów dla enzymu, tak że ryzyko niedoceniania ilości obecnej w próbkach z powodu deficytu substratu lub ekstremalnych warunków kwasowości lub zasadności nie działa.
Przez immunohistochemię
Inna metoda, być może nieco bardziej nowoczesna, do określenia obecności dehydrogenazy mleczanowej ma związek z użyciem narzędzi immunologicznych, to znaczy z zastosowaniem przeciwciał.
Może ci służyć: homologia (biologia)Metody te wykorzystują powinowactwo między połączeniem antygenu z przeciwciałem generowanym specjalnie przeciwko niemu i są bardzo przydatne do szybkiego określenia obecności lub braku enzymów, takich jak LDH w określonej tkaninie.
W zależności od celu zastosowane przeciwciała muszą być specyficzne do wykrywania dowolnego z izoenzymów lub dla dowolnego białka z dehydrogenazą aktywności mleczanowej.
Po co określić mleczan dehydrogenazy?
Określenie tego enzymu jest wykonywane z różnymi celami, ale głównie w przypadku diagnozy klinicznej niektórych stanów, w tym zawału mięśnia sercowego i raka.
Na poziomie komórkowym uwalnianie mleczanu dehydrogenazy zostało uznane za jeden z parametrów w celu określenia występowania procesów nekrotycznych lub apoptotycznych, ponieważ błona plazmatyczna staje się przepuszczalna.
Produkty reakcji, którą Catalyz można również określić w tkaninie, aby ustalić, czy metabolizm beztlenowy z pewnego szczególnego powodów trwa metabolizm.
Reakcja
Jak początkowo skomentowano, enzym dehydrogenaza mleczanowa, której systematyczna nazwa jest (S) -Lactato: NAD+ dehydrogenaza, konwersja mleczanu katalizatora w pirogronian+ zależne lub odwrotnie, które występuje dzięki przeniesieniu jonu wodordu (h-) Od pirogronianu do mleczanu lub od NADH do utlenionego pirogronianu.
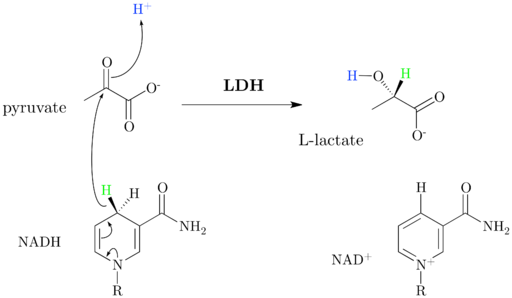 Schemat i mechanizm reakcji mleczanu dehydrogenazy (źródło: JazzlW [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Schemat i mechanizm reakcji mleczanu dehydrogenazy (źródło: JazzlW [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) NAD+ Ma jednostkę ADP i inną grupę nukleotyczną pochodzącą z kwasu nikotynowego, zwaną także niacyną lub witaminą B3, I ten koenzym uczestniczy w wielu reakcjach o wielkim znaczeniu biologicznym.
Ważne jest, aby podkreślić, że równowaga w tej reakcji jest przesunięta z boku odpowiadającym mleczanowi i wykazano, że enzym jest również w stanie utleniać inne kwasy (S) -2 -hydroximonokarboksyl i użycie, choć mniej wydajnie, NADP+ jako podłoże.
W zależności od obszaru ciała, który jest rozważany, a jednocześnie jego cechy metaboliczne w odniesieniu do obecności lub braku tlenu, tkanki wytwarzają różne ilości mleczanu, produkt reakcji katalizowany przez LDH.
Jeśli na przykład czerwone krwinki (erytrocyt), w którym brakuje mitochondriów, które mogą metabolizować pirogronian wytwarzany podczas glikolizy do CO2 I woda, wtedy można powiedzieć, że są to główne komórki wytwarzające mleczan w ludzkim ciele, ponieważ cały pirogronian jest przekształcany na mleczan przez działanie mleczanu dehydrogenazy.
Z drugiej strony, jeśli wzięte pod uwagę komórki wątroby i komórki mięśnia szkieletowego, są one odpowiedzialne za wytwarzanie minimalnej ilości mleczanu, biorąc pod uwagę fakt, że jest to szybko metabolizowane.
Może ci służyć: Sabouraud Agar: What Is, Foundation, Preparation, UżyjWartości normalne
Stężenie dehydrogenazy mleczanowej w surowicy krwi jest wynikiem ekspresji kilku izoenzymów w wątrobie, serca, mięśniach szkieletowych, erytrocytach i guzach, między innymi.
W surowicy krwi normalne zakresy aktywności mleczanu dehydrogenazy wynoszą od 260 do 850 U/ml (jednostki na mililitr), przy średniej wartości 470 ± 130 U/ml. Tymczasem hemoralizowane krwi mają aktywność LDH, która waha się między 16.000 i 67.000 U/ml, co jest równoważne średnio 34.000 ± 12.000 u/ml.
Co to znaczy mieć wysoki LDH?
Ocena ilościowa stężenia dehydrogenazy mleczanowej w surowicy krwi ma ważną wartość w diagnozowaniu niektórych serca, wątroby, chorób krwi, a nawet nowotworów.
Wysokie liczby aktywności LDH stwierdzono u pacjentów z zawałem mięśnia sercowego (zarówno eksperymentalnego, jak i klinicznego), a także u pacjentów rakowych, szczególnie u kobiet z rakiem endometrium, jajnikiem, piersi i macicy.
W zależności od konkretnego izoenzymu, który jest „nadmiaru” lub w wysokim stężeniu, kwantyfikacja izoenzymów mleczanu dehydrogenazy jest stosowana przez wielu lekarzy w celu ustalenia urazów tkanek (poważne lub przewlekłe).
Bibliografia
- Bergmeyer, godz., Bent, e., & Hess, b. (1961). Dehydrogenaza mlekowa. Metody analizy enzymatycznej. Seelag Chemie, GmbH.
- Chung, f., TSUJUBO, godz., Bhattacharyya, u., Sharief, f., & Li, s. (1985). Genomowa organizacja ludzkiego dehydrogenazy mleczanu-A. Journal Biochemical, 231, 537-541.
- Becker, d. (2003). Kwasica mlekowa. Med o intensywnej opiece, 29, 699-702.
- Nawet J., & Kaplan, n. (1973). Dehydrogense mleczanu: struktura i funkcja. W Postęp w enzymologii i powiązanych obszarach biologii molekularnej (PP. 61-133).
- Fox, s. Siema. (2006). Ludzka psychologia (9 wyd.). Nowy Jork, USA: McGraw-Hill Press.
- Huijgen, h., Sanders, g. T. B., Koster, r. W., Vreeken, J., & Bossuyt, p. M. M. (1997). Wartość kliniczna dehydrogenazy mleczanowej w surowicy: przegląd ilościowy. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Komitet Nomenklatury Międzynarodowej Związku Biochemii i Biologii Molekularnej (NC-IBMB). (2019). Pobrano z www.Qmul.AC.UK/SBCS/IUBMB/Enzyme/indeks.Html
- Rawn, J. D. (1998). Biochemia. Burlington, Massachusetts: Neil Patterson Publishers.
- Usatelui-gomez, m., Wicks, r. W., & Warshaw, m. (1979). Immunochemiczne oznaczanie izoenzymu serca dehydrogenazy mleczanowej (LDH1) w ludzkiej surowicy. Clin Chem, 25(5), 729-734.
- Wrólewski, f., & Ladue, j. S. (1955). Aktywność degydrogenazy mlekowej we krwi. Eksperymentalna biologia i medycyna, 90, 210-215.

