Charakterystyka lamininy, struktura, funkcje, typy
- 4693
- 677
- Matylda Duda
Laminina Jest to jedno z białek, które stanowi matrycę zewnątrzkomórkową błony podstawnej tkanek nabłonkowych u zwierząt kręgowców. Ten typ białka zapewnia wsparcie wiązania między komórkami tkanki spojówki, tak że działają one w kohezji i zagęszczeniu tych.
Zasadniczo lamininy są odpowiedzialne za zamówienie skomplikowanej sieci białek, która tworzy matrycę pozakomórkową lub błonę tkanki podstawowej. Zazwyczaj lamininy są związane z białkami takimi jak kolagen, proteoglikany, entaktyny i hepar siarczan.
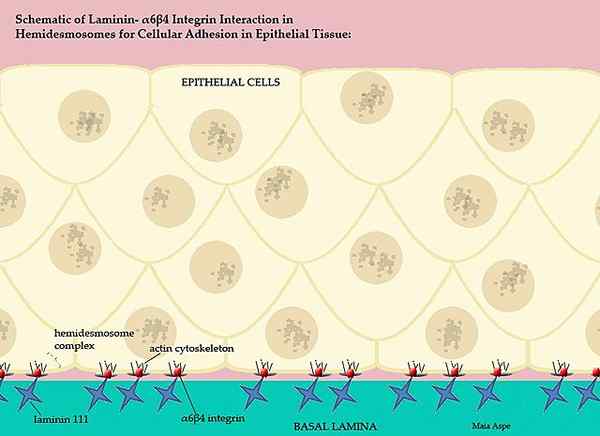
 Lamininy i ich udział w podstawowej błonie kręgowskiej (Źródło: Maiaaspe/CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons)
Lamininy i ich udział w podstawowej błonie kręgowskiej (Źródło: Maiaaspe/CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons) Ta skomplikowana błona podstawa, uporządkowana przez lamininy, oddziela części nabłonkowe tkanek, to znaczy każda matryca pozakomórkowa oddziela śródbłonek od mezototio i matrycy pozakomórkowej mezotelito oddziela tę warstwę od nabłonka.
Wiele badań wykazało, że ekspresja zmutowanych genów laminin jest potencjalnie śmiertelna dla komórki, ponieważ są one również odpowiedzialne za regulację prawie wszystkich złożonych interakcji, które występują w błonie podstawowej.
Istnieje wielka różnorodność rodzin laminin we wszystkich kręgowcach. Różnią się one składem, formą, funkcją i pochodzeniem. W tej samej jednostce w różnych tkankach można znaleźć różne lamininy, każde zaadaptowane do otoczenia tkanki, które ją wyraża.
[TOC]
Charakterystyka lamininy
Monomery lub jednostki lamininowe składają się z innej heterotromeru łańcuchów glikoprotein. Białka te zawierają wiele różnych domen (wielobarstwowe) i są istotną częścią wczesnego embrionalnego rozwoju tkanek.
Wspólna forma laminin jest rodzaj „krzyża” lub „y”, chociaż niektóre mają długi kształt paska z czterema konsekwencjami. Ta niewielka zmienność pozwala każdemu typowi lamininy regularnie odpowiednia integracja z dowolnej pozycji w tkance.
Może ci służyć: p-nitrofenol: Charakterystyka, zastosowania i toksycznośćLamininy mają wysoką masę cząsteczkową, która może się różnić w zależności od rodzaju lamininy, od 140 do 1000 kDa.
Ogólnie rzecz biorąc, każda błona podstawy ma w środku jeden lub kilka różnych rodzajów laminin, a niektórzy naukowcy proponują, że lamininy określają dużą część funkcji fizjologicznej błon podstawowych tkanki, w której się znajdują.
U zwierząt kręgowców znaleziono co najmniej 15 różnych rodzajów laminin, sklasyfikowanych w rodzinie, ponieważ powstają one z tego samego trymera, ale z różnymi kombinacjami. U zwierząt bezkręgowców, które znaleźli od 1 do 2 różnych trimerów.
Obecne badania sugerują, że lamininy wszystkich zwierząt kręgowców powstały poprzez różnicowanie ortologów, to znaczy wszystkie geny kodujące lamininy mają wspólne pochodzenie zwierząt bezkręgowych.
Struktura
Pomimo dużej liczby funkcji regulujących lamininy, mają one dość prostą strukturę, która w większości jest zachowana wśród różnych znanych rodzajów.
Każda laminina składa się z trzech różnych łańcuchów splecionych ze sobą, tworząc rodzaj „przeplatanego włókna”. Każdy z trzech łańcuchów jest identyfikowany jako Alfa (α), beta (β) i gamma (γ).
Tworzenie trimera każdej lamininy zależy od połączenia regionu C-końcowego każdego z jego łańcuchów. Wewnątrz każdej cząsteczki łańcuchy te są sparowane przez łącza peptydowe i trzy mosty disiarczkowe, które nadają strukturze wielki oporność mechaniczna.
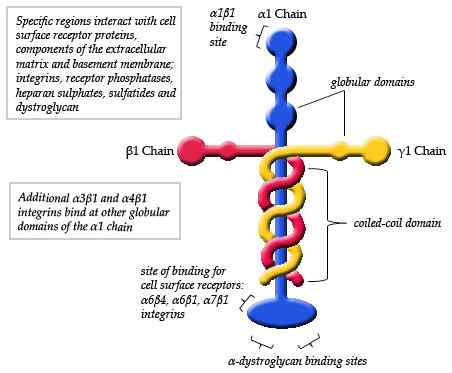 Schematyczny schemat struktury lamininy (źródło: Maiaaspe/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons)
Schematyczny schemat struktury lamininy (źródło: Maiaaspe/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons) Obserwacje dokonane za pomocą mikroskopii elektronicznej typowych monomerów lamininy szczegółowo opisano, że struktura jest rodzajem asymetrycznego krzyża, który ma długie ramię około 77 nm (nanometry), które charakteryzuje się wyraźnym kształtem kuliste na jednym z jej końca.
Może ci służyć: dynamika populacjiPonadto obserwuje się trzy krótkie ramiona, dwa z około 34 nm i jeden z około 48 nm. Każde ramię kończy się na jednym kulisie, podobnie jak łańcuch główny, ale mniejszy rozmiar.
Różnica między różnymi typami laminin wynika głównie z różnic w łańcuchach α, które można złożyć na co najmniej trzy różne sposoby; Chociaż obecnie zidentyfikowano zmiany dla wszystkich łańcuchów:
- 5 różnych wariantów lub łańcuchów lamininy α
- 3 zmiany łańcuchów β
- 3 zmiany dla łańcuchów γ
Funkcje
Najważniejszą i powszechnie badaną funkcją laminin jest interakcja z receptorami zakotwiczonymi w błonach komórkowych komórek przylegających do błon podstawowych, w których się znajdują.
Ta interakcja sprawia, że białka te są zaangażowane w regulację wielu aktywności komórkowej i drogów sygnalizacyjnych. Ma to na celu wspomnienie, że ich funkcje zależą od ich interakcji ze specyficznymi receptorami na powierzchni komórki (wiele receptorów błonowych jest obecnie klasyfikowanych zgodnie z ich zdolnością do zjednoczenia do laminin).
Integryny to receptory, które oddziałują z lamininami i receptorami nieintegrinami ”to te, które nie mają zdolności do łączenia tych białek. Większość receptorów „nieintegrinowych” to proteoglikany, niektóre dystroglikany lub syndekan.
Dojrzewanie tkanek narządów ciała odbywa się z zastąpieniem wczesnych laminin, które początkowo znajdowały się w błonie podstawowej tkanek, które utworzyły narządy młodzieżowe.
W obrębie lamininy typem, który najbardziej badany jest laminina-1, który jest bezpośrednio powiązany ze wzrostem aksonów praktycznie dowolnego rodzaju neuronu w warunkach In vitro, Ponieważ regulują ruch „stożka wzrostu” na powierzchni neuronów.
Może ci służyć: bulion mocznika: co to jest, podkład, przygotowanie, użyciaNomenklatura i typy
Biochemicy uważają rodzinę laminin za bardzo dużą rodzinę białka, z której niewielu jego członków jest nadal znanych. Jednak nowoczesne narzędzia pozwolą na dostrzeganie nowych rodzajów laminin.
Takie białka są identyfikowane z liczbą, zaczynając od 1 zakończenia numerowania w 15 (laminina-1, laminina-2 ... laminina-15).
Używany jest również inny rodzaj nomenklatury, który wskazuje, jaki rodzaj łańcucha ma każda laminina. Na przykład laminina -11 składa się z łańcucha alfa (α) -5, przez łańcuch beta (β) -2 i łańcuch gamma (γ) -1, więc można ją nazwać laminina -521.
Ponadto każda laminina jest klasyfikowana zgodnie z funkcją, z którą jest powiązana, a także zgodnie z konkretną tkanką ciała, w której uczestniczy. Niektóre przykłady laminin to:
- Lamin-1: który uczestniczy w rozwoju nabłonka
- Laminina-2: Zaangażowany w rozwój miogeniczny wszystkich tkanek, obwodowego układu nerwowego i matrycy kłębuszkowej.
- LAMINA-3: Uczestnicz w związkach My-Tendinous
- Blaszka-4: Działa w związkach nerwowo-mięśniowych i mezangialnej matrycy kłębuszków
- Laminina-5, 6 i 7: działają najlepiej w tkankach naskórka.
Bibliografia
- Miner, J. H., & Yurchenco, p. D. (2004). Funkcje lamininy w morfogenezie tkanek. Annu. Obrót silnika. Dev. Biol., 20, 255-284.
- Rasmussen, zm. G. K., & Karsdal, m. DO. (2016). Lamininy. W biochemii kolagenów, laminin i elastyny (PP. 163-196). Academic Press.
- Sasaki, t., Fässler, r., I Hohenester i. (2004). Laminina: sedno zespołu błony piwnicy. The Journal of Cell Biology, 164 (7), 959-963.
- Timpl, r., Engel, J., & Martin, G. R. (1983). Wielofunkcyjne białko laminina A błony piwnicznej. Trendy w naukach biochemicznych, 8 (6), 207-209.
- Timpl, r., Rohde, h., Robey, s. 1. G., Rennard, s. Siema., Foidart, J. M., & Martin, G. R. (1979). Glikoproteina laminina-A z błon piwnicznych. Journal of Biological Chemistry, 254 (19), 9933-9937.
- Tryggvason, k. (1993). Rodzina laminin. Obecna opinia w biologii komórkowej, 5 (5), 877-882.

