Joseph Thomson

- 3696
- 221
- Arkady Sawicki
 J.J. Thomson
J.J. Thomson Joseph John Thomson (1856–1940) To był brytyjski chemik High. Zdobył Nagrodę Nobla w dziedzinie fizyki w 1906 roku.
Urodził się w Cheetam Hill, dzielnicy Manchesteru w Anglii, 18 grudnia 1856 r. Znany również jako „J.J.„Thomson studiował inżynierię w Owens College, obecnie część University of Manchester, a następnie matematyki w Cambridge.
W 1890 r. J.J. Thomson poślubił Rose Elizabeth Paget, córkę doktora Sir Edwarda George'a Pageta, z którym miała dwoje dzieci: dziewczynkę o imieniu Joan Paget Thomson i dziecko, George Paget Thomson.
Ten ostatni stałby się słynnym naukowcem, zdobywając w 1937 r. Nagrodę Nobla w dziedzinie fizyki za pracę z elektronami.
Od najmłodszych lat Thomson skupił swoje badania na strukturze atomów, odkrywając w ten sposób istnienie elektronów i izotopów, wśród wielu innych ich wkładów.
W 1906 r. Thomson otrzymał Nagrodę Nobla w dziedzinie fizyki, „w uznaniu za wielką zaletę jego teoretycznych i eksperymentalnych badań nad przewodnictwem energii elektrycznej przez gaz”, jak ustalono jury w wyroku wyżej wymienionej nagrody nagrody.
W 1908 r. Został mianowany Knight przez brytyjską koronę i pełnił funkcję profesora fizyki w Cambridge i Royal Institute w Londynie.
Zmarł 30 sierpnia 1940 r. W wieku 83 lat w mieście Cambridge w Anglii. Fizyk został pochowany w opactwie Westminster, w pobliżu grobowca Sir Isaaca Newtona.
Wkład Josepha Thomsona w naukę i chemię
Odkrycie elektronów
W 1897 r. J.J. Thomson odkrył nową cząsteczkę światła niż wodór, który został ochrzczony „elektron”.
Może ci służyć: określenie popiołów: metody i przykładyWodór uznano za jednostkę pomiarową masy atomowej. Do tego czasu atom był najmniejszym podziałem materii.
W tym sensie Thomson jako pierwszy odkrył negatywnie obciążone cząstki subatomowe.
Model atomowy Thomsona
Model atomowy Thomsona był strukturą, którą angielski fizyk przypisał atomom. Dla naukowca atomy były sferą ładunku dodatnią.
Były wbudowane ujemnie rozłożone elektrony równomiernie na tej dodatniej chmurze obciążenia, to znaczy neutralizując dodatnie obciążenie ciasta atomowego.
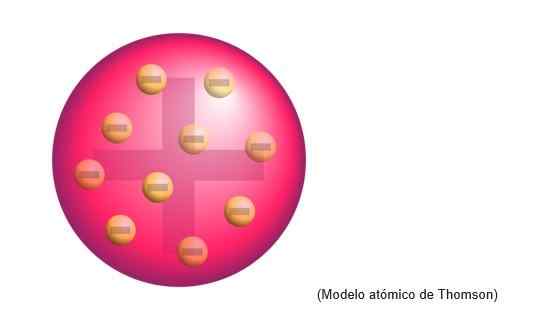
Ten nowy model zastępuje rozwinięte przez Dalton, a później zostanie obalony przez Rutherford, uczeń Thomsona w Cavendish Laboratories of Cambridge.
Oddzielenie atomów
Thomson zastosował promienie dodatnie lub anodowe do oddzielenia atomów od innej masy. Ta metoda pozwoliła mu obliczyć energię elektryczną transportowaną przez każdy atom i liczbę cząsteczek na centymetr sześcienny.
Możliwość podzielenia atomów różnej masy i obciążenia fizyk odkrył istnienie izotopów. Również w ten sposób, wraz z badaniem promieni pozytywnych, stworzył wielki postęp w kierunku spektrometrii masowej.
Odkrycie izotopów
J.J. Thomson odkrył, że jony neonowe miały różne masy, to znaczy inna waga atomowa. W ten sposób Thomson pokazał, że neon ma dwa podtypy izotopów, neon-20 i neon-22.
Izotopy, badane do dziś, są atomami tego samego elementu, ale ich jądra mają różną liczbę masy, ponieważ składają się z różnych ilości neutronów w swoim centrum.
Eksperymenty z promieniami katodowymi
Promienie katodowe to prądy elektronowe w rurkach próżniowych, to znaczy szklane rurki z dwiema elektrodami, jedną pozytywną i jedną ujemną.
Może ci służyć: wodorotlenek chromu: struktura, właściwości, synteza, zastosowaniaGdy elektroda ujemna jest podgrzewana, zwana również katodą, emituje promieniowanie skierowane w kierunku elektrody dodatniej lub anody, w linii prostej, jeśli w tej trasie nie występuje pole magnetyczne.
Jeśli szklane ściany rurki są pokryte materiałem fluorescencyjnym, zamach stanu katod na tę warstwę powoduje projekcję światła.
Thomson zbadał zachowanie promieni katodowych i doszedł do wniosków, że promienie rozprzestrzeniły się prosto.
Doszedł również do wniosku, że promienie te można odwrócić od ich trajektorii przez obecność magnesu, to znaczy pola magnetycznego. Ponadto promienie mogły poruszać łopatami z cyrkulacją elektronów, co pokazuje, że elektrony miały masę.
J.J. Thomson doświadczył gazu wewnątrz rurki promieniowej katody, ale zachowanie elektronów nie różniło się. Podobnie promienie katodowe ogrzały obiekty, które wkładały na drogę między elektrodami.
Podsumowując, Thomson wykazał, że promienie katodowe miały efekty światła, mechaniczne, chemiczne i termiczne.
Rurki Ray Cathode i ich właściwości światła były transcendentalne dla późniejszego wynalezienia telewizji lampowej (CTR) i kamer wideo.
Spektrometr masowy
J.J. Thomson stworzył pierwsze podejście do Spektrometr masowy. To narzędzie pozwoliło na badanie naukowców.
W tym dochodzeniu doszedł do wniosku, że promienie katodowe składały się z ciałek obciążenia ujemnego, które znajdują się wewnątrz atomów, postulując w ten sposób podzielność atomu i powodując liczbę elektronów.
Może ci służyć: kwas butynowy: wzór, właściwości, ryzyko i zastosowaniaRównież postępy w spektrometrii masowej trwały do dziś, ewoluując w różnych metodach oddzielenia elektronów od atomów.
Ponadto Thomson jako pierwszy sugerował Pierwszy przewodnik fali w 1893 r. Ten eksperyment składał się z rozprzestrzeniania się.
Przewodniki falowe byłyby szeroko stosowane w przyszłości, nawet dzisiaj, z transmisją danych i światłowodem optycznym.
Dziedzictwo Thomsona
Thomson (TH) został ustanowiony jako jednostka obciążenia masowego w spektrometrii mas, zaproponowana przez Cooks i Rockwood Chemicals, na cześć Thomsona.
Ta technika pozwala określić rozkład cząsteczek substancji zgodnie z ich masą i, rozpoznanie przez to, które są obecne w próbce materii.
Formuła Thomsona (TH):
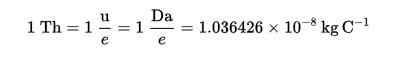
Znakomite prace
- Dokonanie energii elektrycznej przez gazy, energia elektryczna przez gazy (1900).
- Korpusowa teoria materii, elektron w chemii i wspomnienia i refleksjach (1907).
- Beyond the Electron (1928).
Bibliografia
- Nobel Media AB (2014). J. Thomson - biograficzny. Nagroda Nobla.org. Nagroda Nobla.org.
- Thomson, Joseph J., Energia elektryczna poprzez zachowanie gazów. Cambridge, University Press, 1903.
- Menchaca Rocha, Arturo. Dyskretny urok elementarnych cząstek.
- Christen, Hans Rudolf, Podstawy chemii ogólnej i nieorganicznej, tom 1. Barcelona, Hiszpania. Edycje reverté s.DO., 1986.
- Arzani, Aurora Cortina, Podstawowa chemia ogólna. Meksyk, redakcja Porrúa, 1967.
- R. G. Kucharze, a. L. Rockwood. Rapid Commun. Spektro masowe. 5, 93 (1991).

