Struktura Isopentano, właściwości, zastosowania, uzyskiwanie
- 1897
- 18
- Matylda Duda
On Isopentano Jest to związek organiczny, którego skondensowana formuła jest (ch3)2Chch2Ch3. Jest to alkan, w szczególności rozgałęziony izomer Pentan, charakteryzujący się bardzo lotną cieczą i używa jako środek musujący. Obecnie jego najbardziej zalecaną nazwą przez IUPAC to 2-metylobutan.
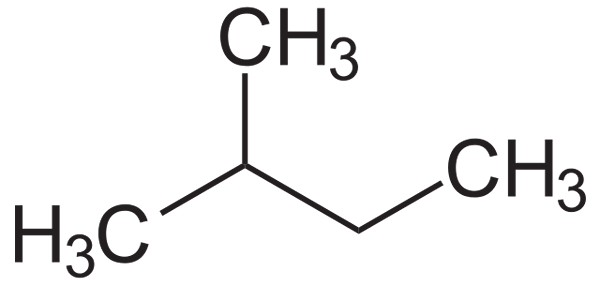
Na dolnym obrazie można zobaczyć jego formułę strukturalną. Zauważ, że grupa ch3 skutecznie jest powiązany z węglem 2 łańcucha butylu. Z izopentano uzyskuje się izopentil lub izopentilowy rodnik, będąc jednym z najbardziej nieporęcznych podstawników alquilicznych, które mogą być.
 Strukturalna formuła izopentano. Źródło: Neuropoger / domena publiczna
Strukturalna formuła izopentano. Źródło: Neuropoger / domena publiczna Isopentano jest niepolarnym, hydrofobowym i łatwopalnym związkiem. Jego zapach jest podobny do zapachu benzyny i jest częścią jego składu, ponieważ zwiększa liczbę oktanową lub oktanową. Jest uzyskiwany z reakcji izomeryzacji N-Pentano, choć oczywiście osiąga się to w kilku ilościach w rezerwach gazu ziemnego.
Odkładając na bok swój wysoce łatwopalny charakter, izopentano jest uważane za substancję nietoksyczną. Osoba może je spożywać i poczuć z umiarem przed przedstawieniem niepożądanych objawów, takich jak chęć wymiotowania i zawrotów głowy. Isopentano można znaleźć w kremach brzytwa i odżywkach włosów.
[TOC]
Struktura Isopentano
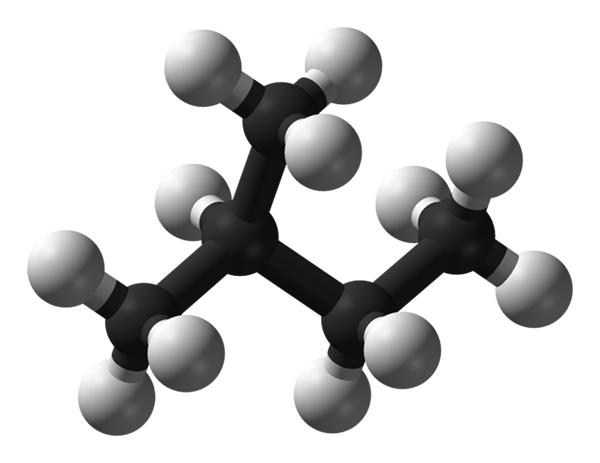 Struktura molekularna Isopentano. Źródło: Benjah-BMM27 przez Wikipedia.
Struktura molekularna Isopentano. Źródło: Benjah-BMM27 przez Wikipedia. Na lepszym obrazie mamy strukturę molekularną izopentano, reprezentowaną przez model kul i słupków. Czarne kule odpowiadają atomom węgla, podczas gdy biała kule z atomem wodoru. Z jego gazowanego szkieletu można powiedzieć, że jest solidny, rozgałęziony i nieporęczny.
Może ci służyć: reakcja przemieszczeniaKońce cząsteczki izopentano są rozumiane przez grupy CH3, które są nieefektywne, jeśli chodzi o wzmocnienie interakcji międzycząsteczkowych. Cząsteczki Isopentano zależą od sił dyspersyjnych Londynu i ich mas, aby móc pozostać spójnym, a tym samym zdefiniować ciecz w normalnych warunkach temperatury i ciśnienia.
Jednak jego geometria i grupy3 Są odpowiedzialne za wysoce lotny płyn izopentano i wrze w temperaturze 28.2 ° C. Na przykład liniowy izomer N-Pentano wrzenia o około 36 ° C, co jest odzwierciedleniem najlepszych interakcji międzycząsteczkowych.
Pomimo pozornej odporności cząsteczka izopentano jest w stanie przyjąć kilka konfiguracji przestrzeni, co jest kluczowym czynnikiem ustanawiania szkła w temperaturze -160 ° C.
Nieruchomości
Wygląd fizyczny
Gaz płynny lub bezbarwny, z wodnym wyglądem, a to również daje zapach podobny do zapachu benzyny. Jest to bardzo lotna substancja.
Temperatura topnienia
Isopentano krystalizuje przedział temperatury między -161 i -159 ºC.
Punkt wrzenia
Isopentano wrzenia w odstępie temperatury między 27.8 i 28.2 ° C. Dlatego ledwo odsłonięto poza pojemnikiem.
Ciśnienie pary
76.9 kPa w 20 ° C (około 0.76 atm)
Gęstość
0.6201 g/ml w 20 ° C. Pary Isopentano to 2.48 gęstsze niż powietrze.
Rozpuszczalność
Isopentano za bycie substancją nietopeczkową jest nierozpuszczalna i niemiecalna z wodą i niektórymi alkoholem. Jest rozpuszczalny i mieszalny w rozpuszczalnikach parafinowych, eterach, tetrachlorku węgla, a także w płynach aromatycznych, takich jak toluen.
Może ci służyć: związki czwartorzędowe: cechy, szkolenie, przykładyWspółczynnik załamania światła
1.354
Napięcie powierzchniowe
15 dyn/cm przy 20 ° C
Breja
0.214 CP w 20 ° C
Punkt flash
-51 ° C. Ta temperatura sprawia, że izopentano.
Temperatura samo -kierunkowego
420 ° C
Aplikacje
 Kremy uczuć zawierają małe ilości izopentano, które działają jako pędność i nadają konsystencję produktu. Źródło: Pixabay.
Kremy uczuć zawierają małe ilości izopentano, które działają jako pędność i nadają konsystencję produktu. Źródło: Pixabay. Isopentano jest rozpuszczalnikiem organicznym, który służy jako sposób reakcji dla pewnej syntezy organicznej, a także reprezentuje surowiec do produkcji innych związków.
Jest dodawany do benzyny, aby zwiększyć oktan i do kilku produktów kosmetycznych, aby poprawić jego konsystencję, takie jak kremy do golenia, kiedyś szybko odparowują i pozostawia za sobą bulgotającą masę.
Podobnie, polistyren zostaje zwilżany w Isopentano, tak że podczas odparowania plastik rozszerza się, tworząc rodzaj pianki, z którymi naczynia, modele, płyty, tace itp.
Z drugiej strony izopentano jest stosowane w kriogenezie, wraz z suchym lodem i ciekłym azotem, aby zamrozić tkanki biologiczne i próbki.
Uzyskanie
Isopentano można uzyskać ze zbiorników gazu ziemnego, choć tylko 1% jego zawartości.
Kolejna trasa, najczęściej używana na poziomie przemysłowym, opiera się N-Destylowy pentan procesów rafinacyjnych oleju. Potem on N-Pentano przechodzi specjalną reakcję o nazwie izomeryzacja.
Cel izomeryzacji N-Pentano ma uzyskać najbardziej rozgałęzione izomery. Zatem wśród produktów mamy nie tylko izopentano, ale także neopentano. Ta reakcja jest możliwa przy użyciu bardzo specyficznych katalizatorów metali, które kontrolują, jaką temperaturę i jakie ciśnienia są wymagane.
Może ci służyć: właściwości związków kowalencyjnych (z przykładami)Ryzyko
Isopentano jest uważane za substancję nietoksyczną. Wynika to częściowo z jego niskiej reaktywności, ponieważ jego łącza C-C lub C-H nie są łatwe do złamania, więc nie zakłócają takiego w żadnym procesie metabolicznym. W rzeczywistości osoba jest w stanie wdychać dużych ilości opar.
Jego spożycie powoduje nudności i wymioty, a jego kontakt skóry kończy się. Z drugiej strony, badania medyczne nie były w stanie określić, czy izopentano jest substancją rakotwórczą. Jest to jednak uważane za niebezpieczne zanieczyszczenie dla ekosystemów morskich i ich fauny.
Największym niebezpieczeństwem wokół Isopentano jest nie tyle jego reaktywność, ale jego łatwopalność: pali się tlenem powietrza. A ponieważ jego ciecz jest bardzo niestabilna, najmniejsza ucieczka oddzieli wiele opar.
Dlatego produkty zawierające Isopentano muszą być przechowywane w bezpiecznych i świeżych środowiskach.
Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Izopentan. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2020). Izopentan. Baza danych Pubchem. CID = 6556. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Elsevier b.V. (2020). Izopentan. Scientedirect. Pobrano z: Scientedirect.com
- Jennifer ur. Galvin i Fred Marashi. (2010). 2-metylobutan (izopentan). Journal of Toxicology and Environmental Health, część bieżących problemów. Tom 58, 1999 -ISSUE 1-2. doi.Org/10.1080/009841099157403
- « Charakterystyka lipidów, struktura, funkcje, przykłady
- Charakterystyka etyki zawodowej, znaczenie, kod, przykłady »

