Jonizacja w koncepcji fizyki i chemii, proces i przykłady

- 4288
- 866
- Bertrand Zawadzki
jonizacja To wszystko ten proces, w którym obciążenia elektryczne są generowane z neutralnych cząstek. Może to odbywać się poprzez różne naturalne mechanizmy lub siły, przez promieniowanie, ciepło, pola elektryczne, pola magnetyczne lub reakcje chemiczne. Jony powstają w konsekwencji, które są atomami dodatnio lub negatywnie.
Jonizacja jest fundamentalnym procesem symfin zjawisk fizycznych, chemicznych lub naturalnych, przy czym ten ostatni jest wielokrotnie mieszanką zmian fizykochemicznych. Na przykład w jonizacjach fizycznych w zasadzie nie występują reakcje chemiczne; Oznacza to, że produkcja jonów nie oznacza załamania ani powstawania nowych linków.
 Wiele zjawisk naturalnych, takich jak północne światła, opiera się na jonizacji cząsteczek atmosfery. Źródło: Pixabay.
Wiele zjawisk naturalnych, takich jak północne światła, opiera się na jonizacji cząsteczek atmosfery. Źródło: Pixabay. Jednak w zjawiskach naturalnych tej jonizacji zwykle towarzyszy reakcje chemiczne, takie jak tworzenie ozonu na niskich wysokościach. Ponadto podczas burz tlenków azotu są wytwarzane z powodu promieni i ich intensywnych temperatur, które utleniają azot powietrza.
Z drugiej strony jonizacja może się zakraść: w tej samej wodzie, w wcieraniu między dwiema powierzchniami, w utlenianiu metali lub w rozpuszczaniu niektórych gazów w wodzie.
[TOC]
Ionizacja chemii
Redukcja utleniania
 Podczas eksploatacji baterii zabawki jony i elektrony są stale. Źródło: D J Shin/CC BY-SA (https: // CreativeCommons.Org/licencje/by-sa/3.0)
Podczas eksploatacji baterii zabawki jony i elektrony są stale. Źródło: D J Shin/CC BY-SA (https: // CreativeCommons.Org/licencje/by-sa/3.0) W jonizacji chemicznej jony są wytwarzane przez łamanie lub tworzenie linków. Dwie substancje zarabiają lub tracą elektrony: ten, który traci elektrony, nabiera dodatnie obciążenie, podczas gdy ten, który wygrywa, zachowuje obciążenie ujemne.
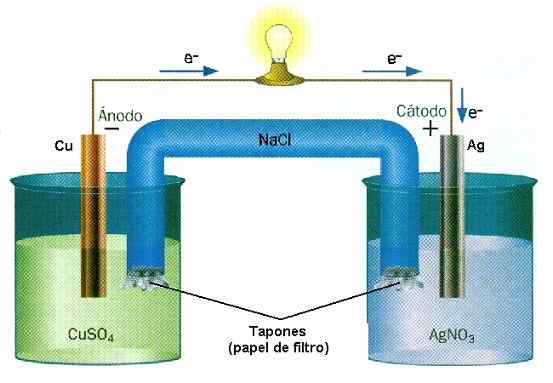
 Przykład redukcji reakcji tlenku w stosie Cu-Ag. Źródło: Water Wall/CC BY-SA (http: // CreativeCommons.Org/licencje/by-sa/3.0/)
Przykład redukcji reakcji tlenku w stosie Cu-Ag. Źródło: Water Wall/CC BY-SA (http: // CreativeCommons.Org/licencje/by-sa/3.0/) W bateriach substancja traci elektrony, a inna je wygrywa. Te elektrony te przemieszczają się i aktywują obwody elektryczne sprzętu, aby w końcu powrócić do drugiego przedziału na stos. Jest to przykład chemicznej jonizacji przeprowadzonej przez reakcję redukcyjną tlenku.
Może ci służyć: kwas glukonowy: struktura, właściwości, synteza, zastosowaniaZerwanie heterolityczne
Inny rodzaj jonizacji chemicznej wynika z heterolitycznego pęknięcia. Kiedy nastąpi ta przerwa, łącze A-B jest zepsute, aby utworzyć jony+ oraz b-, ponieważ elektrony są skierowane w kierunku atomu, dla którego „czują” większe powinowactwo. Heterolityczne pęknięcie jest zwykle pierwszym krokiem, który reguluje mechanizmy wielu reakcji organicznych.
Samoelionizacja
Obciążenia elektryczne mogą nie tylko pojawić się w samym w sobie ruchu elektronów, ale przez łącza, które są zepsute lub tworzone w wymianie atomów. Tak jest w przypadku samokontroli, co dzieje się między dwiema cząsteczkami tego samego związku.
Spośród wszystkich jonizacji chemicznych samokontrola jest najprostsza i najbardziej niezauważalna, ponieważ nie ma zdolności do samodzielnego prowadzenia prądu elektrycznego.
Jonizacja w fizyce
Elektryczność statyczna
 Włosy tej dziewczyny ładują się pozytywnie i odpychają się ze względu na statyczną elektryczność. Źródło: Biseup Ganguly/CC przez (https: // creativeCommons.Org/licencje/według/3.0)
Włosy tej dziewczyny ładują się pozytywnie i odpychają się ze względu na statyczną elektryczność. Źródło: Biseup Ganguly/CC przez (https: // creativeCommons.Org/licencje/według/3.0) Jonizacja ma również duży udział w zjawiskach fizycznych. Zasadniczo jonizacja fizyki nie oznacza reakcji chemicznych. Atomy materii są naładowane elektrycznie bez utraty pierwotnej tożsamości.
Powierzchnie mogą wymieniać elektrony, gdy pocierają się, jeśli jeden z nich jest bardziej skuteczny w ich przechowywaniu, co prowadzi do statycznej energii elektrycznej. Nie mówi już o atomach, ale o całym materiale, który nabywa obciążenie ujemne lub dodatnie, a po przywróceniu równowagi, porażenie elektryczne może dosłownie generować między dwoma materiałami lub ciałami.
Jonizacja gazowa
Rozpuszczone atomy gazowe mogą stracić elektrony, jeśli są poddane polu elektrycznego. W ten sposób atomy są podekscytowane i uwolnione elektrony. Następnie, podczas chłodzenia i wracania do swojego statusu jako niewielkiej energii, fotony pożegnają się. A proces powtarza się wielokrotnie. Wynik: źródło oświetlenia lub prądu.
Może ci służyć: tlenek boru (B2O3): co to jest, struktura, właściwości, użyciaPromieniowanie lub kolizje jonizacja
Podobnie materia może zyskać energię zapewnianą przez różne rodzaje promieniowania (gamma, x -wyścig, ultrafiolet itp.) lub zderzając się z cząstkami o wysokiej energii (alfas, bety i neutrony).
Wkładana energia jest taka, że elektron atomu jest natychmiastowy. Ten rodzaj jonizacji jest związany z wieloma zjawiskami radioaktywnymi i kosmicznymi.
Jonizacja wody
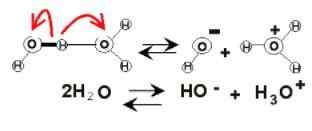 Dysocjacja wody
Dysocjacja wody Na łonie wody mogą pojawić się ładunki elektryczne z powodu jej jonizacji. Jest to chemikalia, ponieważ dwie cząsteczki wody nagle reagują na siebie, aby dysocjować i wygenerować jony H3ALBO+ I och-:
2h2Lub (l) ⇌ h3ALBO+(AC) + OH-(AC)
Ta równowaga została bardzo wysiedlona w kierunku wody, więc prawie nie ma nikogo.
Jonizacja powietrza
Cząsteczki powietrza nie biorą udziału w żadnej równowagi samowystarczalności. Tlen, azot, argon, para wodna i inne gazy tworzące powietrze, nie wymieniają atomów ani elektronów. Dlatego powietrze nie jest dobrym przewodnikiem energii elektrycznej w normalnych warunkach.
Jeśli jednak podlega ono pola elektrycznego, promieniowania lub intensywnych temperatur, może być jonem i stać się dobrym kierowcą. Tak się dzieje na przykład, gdy promienie elektryczne spadają z chmur na ziemię, przemieszczając się w powietrzu z nagłym eksplozją światła.
Przykłady jonizacji
W poprzednich sekcjach wyznaczono niektóre przykłady jonizacji. Wreszcie, niektóre inne zostaną wspomniane.
Utlenianie metalu
Gdy metale utleniają się, albo przez działanie tlenu Ziemi, albo przez atak substancji kwaśnych, nabierają dodatnich ładunków w celu utworzenia odpowiednio tlenków lub soli.
Może ci służyć: proces chemiczny: zasady, typy, przykładyNa przykład żelazo jest jonizowane dzięki tlenu w celu przekształcenia w jony wiary3+, Znajduje się w kryształach tlenków żelaza. Z drugiej strony magnez rozpuszcza się w kwasie siarkowym, aby stracić elektrony i pozostać jako jony MG2+ W soli siarczanu magnezu.
Rozpuszczanie gazu w wodzie
Niektóre gazy, takie jak amoniak i chlorek wodoru, rozpuszczają się w wodzie, aby stracić neutralność i powodować tworzenie jonów. Na przykład amoniak, gdy rozpuszcza częściowo jony NH4+ I och-. Tymczasem chlorek wodoru podczas rozpuszczenia wytworzy h jony H3ALBO+ i Cl- całkowicie.
Podobnym przypadkiem jest rozpuszczanie soli w wodzie, takich jak siarczan magnezu, mgso4. Jednak jony MG2+ A więc42- Są już obecne w kryształach soli przed rozpuszczeniem w wodzie.
Lampy oświetleniowe lub rurki

W lampach parowych lub rurkach oświetleniowych atomy gazowe z porażeniami elektrycznymi są podekscytowani wytwarzaniem określonej ilości światła i kolorów. Na przykład ta jonizacja odbywa się w lampach sodowych lub rtęci, a także w słynnych neonowych światłach z ich jasnymi kolorami w restauracji lub sklepach.
Energie jonizacyjne
Energia jonizacyjna, okresowa właściwość, jest badana w celu scharakteryzowania pierwiastków chemicznych według łatwości, z jaką ich atomy gazowe przekazują elektrony na dodatnie ładowanie. Zatem na przykład metale zwykle mają najniższe energie jonizacyjne, podczas gdy elementy niemetaliczne i szlachetne, najwyższe.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Serway, r., Jewett, J. (2008). Fizyka nauk i inżynierii. Tom 1. 7th. Wydanie. Meksyk. Redaktorzy edukacyjni Cengage.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Jonizacja. Źródło: w:.Wikipedia.org
- Redaktorzy Enyclopaedia Britannica. (17 października 2016 r.). Jonizacja. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Doug Stewart. (2018). Definicja jonizacji: czym jest jonizacja? Odzyskane z: Chemicool.com
- John Zavisa. (1 kwietnia 2020). Jak działa błyskawica. Odzyskane od: nauka.Howstuffwork.com
- « 18 rodzajów zachowań i ich cechy (z przykładami)
- Pochodzenie żółtego liberalizmu, cechy, przyczyny, konsekwencje »

