Interakcje hydrofobowe Czym jest, znaczenie, przykłady
- 3739
- 1024
- Estera Wojtkowiak
Interakcje hydrofobowe (HI) Są to siły, które utrzymują spójność między związkami apolarnymi zanurzonymi w roztworze polarnym lub rozpuszczalniku. W przeciwieństwie do innych interakcji niecześciwach, takich jak mosty wodorowe, interakcje jonowe lub siły van der Waals, interakcje hydrofobowe nie zależą od wewnętrznych właściwości substancji rozpuszczonych, ale raczej od rozpuszczalników.
Bardzo ilustracyjnym przykładem tych interakcji może być separacja fazowa, która występuje, jeśli chodzi o mieszanie wody z olejem. W tym przypadku cząsteczki oleju „oddziałują ze sobą” w wyniku uporządkowania otaczających ich cząsteczek wody.
 Emulsja tłuszczu w wodzie (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons)
Emulsja tłuszczu w wodzie (Catrin Sohrabi [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)], z Wikimedia Commons) Pojęcie tych interakcji istnieje od lat czterdziestych. Jednak termin „link hydrofobowy” został wymyślony przez Kauzmanna w 1959 r., Podczas badania najważniejszych czynników w stabilizacji trójwymiarowej struktury niektórych białek.
Jego są najważniejsze interakcje niespecyficzne, które mają miejsce w systemach biologicznych. Mają również ważną rolę w różnych zastosowaniach inżynierskich oraz w branży chemicznej i farmaceutycznej, którą znamy dzisiaj.
Przyczyna interakcji hydrofobowych
Fizyczna przyczyna jego oparta jest na niezdolności substancji nietoperzych tworzenia wiązań wodorowych z cząsteczkami wody w roztworze.
Są one znane jako „niespecyficzne interakcje”, ponieważ nie są powiązane z powinowactwem między cząsteczkami substancji rozpuszczonej, ale raczej z tendencją cząsteczek wody do utrzymywania własnych interakcji za pomocą wiązań wodorowych.
Może ci służyć: biosurfaktantyPo kontakcie z wodą cząsteczki apolarne lub hydrofobowe mają tendencję do dodawania spontanicznie, aby osiągnąć większą stabilność poprzez zmniejszenie powierzchni powierzchni kontaktowej z wodą.
Efekt ten można pomylić z silną atrakcją, ale jest to nic więcej niż konsekwencja apolarnego charakteru substancji w odniesieniu do rozpuszczalnika.
Wyjaśniono z termodynamicznego punktu widzenia, te spontaniczne skojarzenia występują w poszukiwaniu stanu energetycznie, w którym masz najmniejszą zmienność energii swobodnej (∆G).
Biorąc pod uwagę to ∆G = ∆H - T∆S, Najbardziej sprzyjającym energetycznie stanem będzie entropia (∆S) Bądź większy, to znaczy, gdzie jest mniej cząsteczek wody, których swoboda obrotowa i translacyjna jest zmniejszona przez kontakt z apolarną substancją rozpuszczoną.
Gdy cząsteczki apolowe są ze sobą powiązane, wymuszone przez cząsteczki wody, uzyskuje się bardziej korzystny stan, niż gdyby te cząsteczki pozostały rozdzielone, każda otoczona „klatką” różnych cząsteczek wody.
Znaczenie biologiczne
Mają duże znaczenie, ponieważ występują w różnorodności procesów biochemicznych.
Wśród tych procesów są zmiany konformacyjne w białkach, zjednoczenie substratów enzymów, związek podjednostek kompleksów enzymatycznych, agregacja i tworzenie błon biologicznych, stabilizacja białek w roztworach wodnych i innych.
W kategoriach ilościowych różni autorzy dali zadanie ustalenia, jakie znaczenie ma jego znaczenie w stabilności struktury dużych ilości białka, stwierdzając, że interakcje te przyczyniają się do ponad 50 %.
Może ci służyć: glukoza oksydazy: charakterystyka, struktura, funkcjeWiele białek błonowych (całka i peryferyjna) jest związanych z dwuwarstwami lipidowymi dzięki HI, gdy w ich strukturach białka te mają domeny hydrofobowe. Ponadto stabilność trzeciorzędowej struktury wielu rozpuszczalnych białek zależy od HI.
Niektóre techniki w badaniu biologii komórkowej wykorzystują właściwość, że niektóre detergenty jonowe POS.
Micele są również stosowane w badaniach farmaceutycznych, które obejmują dostarczanie leków obciążających tłuszcz, a ich tworzenie jest również niezbędne do wchłaniania złożonych witamin i lipidów w ludzkim ciele.
Przykłady interakcji hydrofobowych
Membrany
Doskonałym przykładem HI jest tworzenie błon komórkowych. Takie struktury składają się z dwuwarstwy fosfolipidów. Twoja organizacja jest przekazywana dzięki jego, które występują między ogonami nieopolowymi w „odpychaniu” do otaczającego środowiska wodnego.
Białka
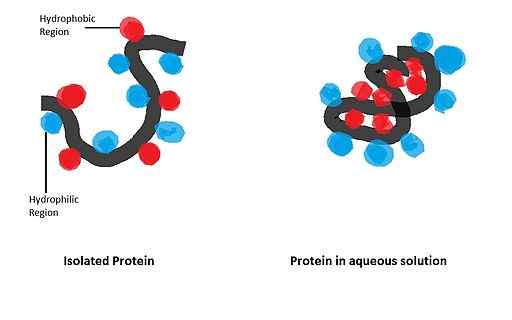
Jego ma duży wpływ na fałdowanie białek kulistych, których biologicznie aktywna postać uzyskuje się po ustaleniu konkretnej konfiguracji przestrzennej, regulowanej obecnością niektórych odpadów aminokwasowych w strukturze.
- Przypadek apomioglobiny
Apomicoglobina (mioglobina pozbawiona grupy HEMO) to małe białko alfa-helikoidalne, które służyło jako model do badania procesu składania i znaczenia jego spośród odpadów niepolarnych w łańcuchu polipeptydowym tego samego tego samego.
W badaniu przeprowadzonym przez Dysona i współpracowników w 2006 r., W którym zastosowano zmutowane sekwencje apomioglobiny, wykazano, że inicjacja zdarzeń składanych tego zależy przede wszystkim od His między aminokwasami z grupami apolowymi.
Może ci służyć: związek między materią a energią obserwowaną w odżywianiu komórekZatem niewielkie zmiany wprowadzone w sekwencji aminokwasowej oznaczają ważne modyfikacje w strukturze trzeciorzędowej, co powoduje słabo uformowane i nieaktywne białka.
Detergenty
Kolejnym jego wyraźnym przykładem jest sposób działania komercyjnych detergentów, którego używamy do celów krajowych każdego dnia.
Detergenty to cząsteczki amfipatyczne (z regionem polarnym i innym niepolarnym). Mogą „emulgować” tłuszcz, ponieważ mają zdolność tworzenia wiązań wodorowych z cząsteczkami wody i mają interakcje hydrofobowe z lipidami obecnymi w tłuszczach.
Po kontakcie z tłuszczem w wodnym roztworze cząsteczki detergentu są ze sobą powiązane w taki sposób, że nie apolowe ogony, otaczające cząsteczki lipidowe i są narażone na powierzchnię grzybki regiony polarne, które wchodzą w kontakt wodny.
Bibliografia
- Chandler, zm. (2005). Interfejsy i siła napędowa hydrofobowego zespołu. Natura, 437(7059), 640-647.
- Dyson, J. H., Wright, s. I., I Sheraga, H. DO. (2006). Rola interakcji hydrofobowych w inicjacji i propagacji fałdowania białka. PNA, 103(35), 13057-13061.

