Immunoglobuliny
- 4983
- 352
- Estera Wojtkowiak
 Ilustracja immunoglobulin
Ilustracja immunoglobulin Co to są immunoglobuliny?
Immunoglobuliny Są to cząsteczki, które wytwarzają limfocyty B i komórki plazmatyczne, które współpracują z obroną organizmu. Składają się z biomolekuły glikoproteiny należącej do układu odpornościowego. Są jednym z najliczniejszych białek surowicy krwi, po albuminie.
Przeciwciało to inna nazwa, którą otrzymują immunoglobuliny i są uważane za globuliny ze względu na ich zachowanie w elektroforezy surowicy krwi, która je zawiera. Cząsteczka immunoglobuliny może być prosta lub złożona, w zależności od tego, czy prezentacja jest monomer.
Wspólna struktura immunoglobulin jest podobna do litery „y”. Istnieje pięć rodzajów immunoglobulin, które mają różnice morfologiczne, funkcjonalne i lokalizacyjne w ciele. Różnice strukturalne przeciwciał nie są w formie, ale pod względem ich składu; Każdy typ ma określony cel.
Odpowiedź immunologiczna promowana przez immunoglobuliny jest bardzo specyficzna i jest bardzo złożonym mechanizmem. Bodziec do wydzielania przez komórki jest aktywowany w obecności dziwnych środków do ciała, takich jak bakteria. Funkcją immunoglobuliny będzie dołączenie do dziwnego elementu i wyeliminowanie.
Immunoglobuliny lub przeciwciała mogą być obecne zarówno we krwi, jak i na błoniastej powierzchni narządów. Te biomolekuły reprezentują ważne elementy w systemie obrony ciała ludzkiego.
Struktura immunoglobulin

Struktura przeciwciał zawiera aminokwasy i węglowodany, oligosacharydy. Dominująca obecność aminokwasów, jego ilość i rozkład jest tym, co określa strukturę immunoglobuliny.
Jak każde białko, immunoglobuliny mają strukturę pierwotną, wtórną, trzeciorzędową i czwartorzędową, określającą ich typowy wygląd.
W odpowiedzi na liczbę prezentowanych przez nich aminokwasów immunoglobuliny mają dwa rodzaje łańcucha: łańcuch ciężki i lekki. Ponadto, zgodnie z sekwencją aminokwasową w jej strukturze, każdy z łańcuchów ma zmienny obszar i stały obszar.
Ciężkie łańcuchy
Ciężkie łańcuchy immunoglobulin odpowiadają jednostkom polipeptydowym składającym się z 440 sekwencji aminokwasowych.
Każda immunoglobulina ma 2 ciężkie łańcuchy, a każdy z nich ma zmienny obszar i stały obszar. Stały region ma 330 aminokwasów i zsekwencjonowane zmienne 110 aminokwasów.
Struktura łańcucha ciężkiego jest inna dla każdej immunoglobuliny. Są to w sumie 5 rodzajów łańcucha ciężkiego, które określają rodzaje immunoglobuliny.
Typy łańcucha ciężkiego są identyfikowane z greckim literami γ, μ, α, ε, δ dla IgG, IgM, IgA, IgE i IgD, odpowiednio.
Stały region łańcuchów ciężkich ε i μ jest tworzony przez cztery domeny, podczas gdy te odpowiadające α, γ, δ mają trzy. Następnie każdy stały obszar będzie inny dla każdego rodzaju immunoglobuliny, ale powszechny dla immunoglobulin tego samego typu.
Może ci służyć: mięsień mosterokleidohioidZmienny region łańcucha ciężkiego powstaje przez pojedynczą domenę immunoglobuliny. Ten region ma sekwencję 110 aminokwasów i będzie różny w zależności od swoistości przeciwciała przez antygen.
W strukturze ciężkich łańcuchów można zaobserwować kątowanie lub zgięcie - zawias - reprezentujący elastyczny obszar łańcucha.
Lekkie łańcuchy
Lekkie łańcuchy immunoglobulin są polipeptydami składającymi się z około 220 aminokwasów. Istnieją dwa rodzaje łańcucha lekkiego w ludzkiej istocie: kappa (κ) i lambda (λ), te ostatnie z czterema podtypami. Stałe i zmienne domeny mają sekwencje 110 aminokwasów każdy.
Przeciwciało może mieć dwa łańcuchy lekkie κ (κκ) lub parę łańcuchów λ (λλ), ale nie jest możliwe posiadanie jednego typu w tym samym czasie.
Segmenty FC i Fab
Ponieważ każda immunoglobulina ma formę podobną do „y”, można podzielić na dwa segmenty. „Niższy” segment, podstawa, nazywa się frakcją krystaliczną lub FC; podczas gdy ramiona „y” tworzą Fab lub ułamek, który łączy antygen. Każda z tych strukturalnych sekcji immunoglobuliny wykonuje inną funkcję.
Segment FC
Segment FC ma dwie lub trzy stałe domeny ciężkich łańcuchów immunoglobuliny.
FC może łączyć białka lub specyficzny odbiornik w bazofilach, eozynofilach lub komórkach jęczmiennych, więc indukuje specyficzną odpowiedź immunologiczną, która wyeliminuje antygen. FC odpowiada końca karboksylowej immunoglobuliny.
Segment Fab
Frakcja lub fragment przeciwciała zawiera zmienne domeny na jego końcach, oprócz stałych domen ciężkich i lekkich łańcuchów.
Stała domena łańcucha ciężkiego trwa wraz z domenami segmentu FC tworzącego zawias. Odpowiada aminowi końcowi immunoglobuliny.
Znaczenie segmentu Fab polega na tym, że pozwala ono zjednoczyć się z antygenami, dziwnymi i potencjalnie szkodliwymi substancjami.
Zmienne domeny każdej immunoglobuliny gwarantują ich swoistość przez dany antygen; Ta funkcja pozwala nawet na stosowanie w diagnozie chorób zapalnych i zakaźnych.
Rodzaje immunoglobulin
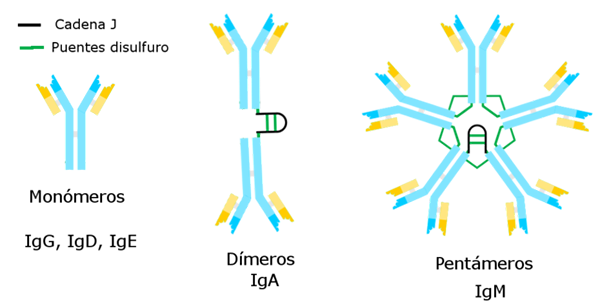 Autor: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)], przez Wikimedia Commons
Autor: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)], przez Wikimedia Commons Znane do tej pory immunoglobuliny mają określony łańcuch ciężki, który jest stały dla każdego z nich i różnica od innych.
Istnieje pięć odmian ciężkich łańcuchów, które określają pięć rodzajów immunoglobulin, których funkcje są różne.
Immunoglobulina G (IgG)
Immunoglobulina G to najliczalna różnorodność. Ma ciężki łańcuch gamma i jest prezentowany w postaci jednorolekularnej lub monomerycznej.
IgG jest najliczniejszy zarówno w surowicy krwi, jak i w przestrzeni tkankowej. Minimalne zmiany w sekwencji aminokwasowej jego łańcucha ciężkiego określa ich podział na podtypy: 1, 2, 3 i 4.
Może ci służyć: mięsakImmunoglobulina G ma sekwencję 330 aminokwasów w odcinku FC i masę cząsteczkową 150 000, z czego 105 000 odpowiada jej łańcuchowi ciężkiego.
Immunoglobulina M (IGM)
Immunoglobulina M jest prędkością, której łańcuch ciężki wynosi μ. Jego masa cząsteczkowa jest wysoka, około 900 000.
Sekwencja aminokwasowa jego łańcucha ciężkiego wynosi 440 w frakcji FC. Jest głównie w surowicy krwi, co stanowi 10 do 12 % immunoglobulin. IGM ma pojedynczy podtyp.
Immunoglobulina A (IGA)
Łańcuch ciężki α odpowiada mu i reprezentuje 15 % całkowitej immunoglobuliny. IGA znajduje się zarówno we krwi, jak i wydzieliny, nawet w mleku matki, przedstawiającą w postaci monomeru lub dimeru. Masa cząsteczkowa tej immunoglobuliny wynosi 320 000 i ma dwa podtypy: IgA1 i IgA2.
Immunoglobulina E (IGE)
Immunoglobulina E składa się z typu łańcucha ciężkiego ε i jest bardzo rzadka w surowicy, około 0,002 %.
IGE ma masę cząsteczkową wynoszącą 200 000 i jest obecna jako monomer głównie w surowicy, śluzu nosa i ślinie. Często często można znaleźć tę immunoglobulinę w bazofilach i komórkach tucznych.
Immunoglobulina D (IGD)
Odmiana łańcucha ciężkiego δ odpowiada immunoglobulinie D, która reprezentuje 0,2 % całkowitej immunoglobuliny. IGD ma masę cząsteczkową wynoszącą 180 000 i jest ustrukturyzowana w postaci monomeru.
Jest to związane z limfocytami B, przyłączone do ich powierzchni. Jednak funkcja IGD nie jest jasna.
Zmiana typu
Immunoglobuliny mogą doświadczyć zmiany typu strukturalnego, ze względu na potrzebę obrony przed antygenem.
Ta zmiana wynika z funkcji limfocytów B przeciwciał produkcyjnych przez adaptacyjną właściwości odpornościowe. Zmiana strukturalna znajduje się w stałym obszarze łańcucha ciężkiego, bez zmiany obszaru zmiennego.
Zmiana klasy lub klasy może spowodować przejście przez IgM do IgG lub IgE, a dzieje się to jako indukowana odpowiedź interferonu gamma lub interlecyn IL-4 i IL-5.
Funkcje immunoglobulin
Rola odgrywana przez immunoglobulin w układzie odpornościowym ma istotne znaczenie dla obrony organizmu.
Immunoglobuliny są częścią humoralnego układu odpornościowego; Oznacza to, że są to substancje wydzielane przez komórki w celu ochrony przed patogenami lub szkodliwymi czynnikami.
Zapewniają skuteczny sposób obrony, skutecznego, specyficznego i systematycznego, mają wielką wartość jako część układu odpornościowego. Mają ogólne i specyficzne funkcje w odporności:
Funkcje ogólne
Przeciwciała lub immunoglobuliny wypełniają zarówno niezależne funkcje, jak i aktywowanie odpowiedzi efektorowych i wydzielniczych za pośrednictwem komórek.
Antigen-Aantinpo Union
Immunoglobuliny mają funkcję łączenia środków antygenowych konkretnie i selektywnie.
Tworzenie kompleksu antygen-przeciwciało jest główną funkcją immunoglobuliny, a zatem jest odpowiedź immunologiczną, która może zatrzymać działanie antygenu. Każde przeciwciało może łączyć dwa lub więcej antygenów jednocześnie.
Może ci służyć: kość pęcherzykówSkuteczne funkcje
Przez większość czasu kompleks antygen-przeciwciało służy jako początek aktywacji specyficznych odpowiedzi komórkowych lub rozpoczęcia sekwencji zdarzeń, które określają eliminację antygenu. Dwie najczęstsze odpowiedzi efektorowe to połączenie komórkowe i aktywacja dopełniacza.
Związek komórkowy zależy od obecności specyficznych receptorów dla segmentu immunoglobuliny FC, po połączeniu antygenu.
Komórki takie jak komórki tuczne, eozynofile, bazofile limfocytów i fagocyty posiadają te receptory i zapewniają mechanizmy eliminacji antygenu.
Aktywacja wodospadu dopełniacza jest złożonym mechanizmem obejmującym początek sekwencji, więc końcowym wynikiem jest wydzielanie toksycznych substancji, które eliminują antygeny.
Określone funkcje
Po pierwsze, każdy rodzaj immunoglobuliny rozwija określoną funkcję obrony:
Immunoglobulina g
- Immunoglobulina G zapewnia większość obrony przed środkami antygenowymi, w tym bakterie i wirusami.
- Aktywne mechanizmy IgG, takie jak dopełniacz i fagocytoza.
- Konkretna konstytucja IgG dla antygenu jest trwała.
- Jedynym przeciwciałem, które matka może przenieść na dzieci podczas ciąży, jest IgG.
Immunoglobulina m
- IGM jest przeciwciałem szybkim reakcji przed szkodliwymi i zakaźnymi środkami, ponieważ zapewnia natychmiastowe działanie, dopóki nie zostanie zastąpione przez IgG.
- To przeciwciało aktywuje odpowiedzi komórkowe włączone do błony humoralnych limfocytów i odpowiedzi, takie jak dopełnienie.
- Jest to pierwsza immunoglobulina, która syntetyzuje człowieka.
Immunoglobulina a
- Działa jak bariera obrony przed patogenami, gdy znajduje się na powierzchniach błon śluzowych.
- Jest obecny w błonie śluzowej oddechowej, układu trawiennego, dróg moczowych, a także w wydzielaniach, takich jak ślina, śluz nosowy i łzy.
- Chociaż jego aktywacja dopełniacza jest niska, może być związane z gładkości w celu wyeliminowania bakterii.
- Obecność immunoglobuliny D zarówno w mleku matki, jak i w faloster.
Immunoglobulina e
- Immunoglobulina i zapewnia silny mechanizm obrony przed producentami alergii.
- Interakcja IgE i alergen sprawi, że substancje zapalne będą odpowiedzialne za objawy alergii, takie jak kichanie, kaszel, ule, wzrost łez i śluz nosowy.
- IgE można również połączyć z powierzchnią pasożytów przez jego segment FC, powodując reakcję, która powoduje śmierć.
Immunoglobulina d
- Monomeryczna struktura IGD jest powiązana z limfocytami B, które nie oddziaływały z antygenami, więc wykonują funkcję receptora.
- Funkcja IGD jest niejasna.

