Fundacja immunofluorescencyjna, protokół i zastosowania
- 2420
- 118
- Estera Wojtkowiak
immunofluorescencja Jest to potężna technika immunomarcy, która wykorzystuje przeciwciała zjednoczone kowalencyjnie do cząsteczek fluorescencyjnych w celu identyfikacji określonych celów w próbkach komórek utrwalonych na solidnym wsparciu.
Ta technika obserwacja mikroskopowa o specyficzności immunologicznej, umożliwiając obserwację żywych lub martwych komórek, które mogą mieć niewielkie ilości antygenów. Jest szeroko stosowany zarówno w dziedzinie badań, jak i w diagnozie klinicznej różnych patologii.
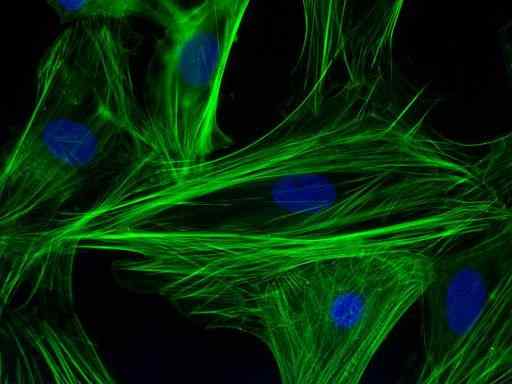
 Immunomarność włókien aktyny w komórkach kardiomiocytów (źródło: PS1415 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Immunomarność włókien aktyny w komórkach kardiomiocytów (źródło: PS1415 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Ta głównie jakościowa technika (z niektórymi wariantami ilościowymi), musi wykonać konkretnie z wizualizacją próbki przez iloczyn fluoroforu, który jest cząsteczką fluorescencyjną przymocowaną do przeciwciała i która jest zdolna do ekscytującej się przy pewnej długości fali długości fali.
W kontekście komórkowym bardzo przydatne jest zbadanie obecności/nieobecności i subkomórkowej lokalizacji białek. Technikę zastosowano na początku w dziedzinie klinicznej do diagnozy wirusów, takich jak grypa, a następnie w wielu innych chorobach zakaźnych.
Jest to technika wielkiej wrażliwości, a przy odpowiednim zespole mikroskopowym może mieć bardzo dobrą rozdzielczość. Wymaga, do obserwacji, zastosowania mikroskopów konfokalnych lub epifluorescencyjnych.
Jednak pomimo tego, że jest bardzo popularny, możesz przedstawić kilka ważnych problemów związanych z uzyskaniem niespecyficznej fluorescencji, która generuje pewien „szum” w tle, co często ogranicza właściwe odczyt wyników.
[TOC]
Podstawa
Immunofluorescencja opiera się na wykorzystaniu biologicznego zjawiska reakcji interakcji między przeciwciałem a antygenem. Musi to zrobić konkretnie z wizualizacją lub wykrywaniem tej reakcji, gdy ekscytujące cząsteczki fluorescencyjne przy określonej długości fali.
Przeciwciało jest białkiem immunoglobuliny wydzielonym z aktywnych komórek B i jest specjalnie generowane przeciwko antygenowi, które można połączyć z wielkim powinowactwem i swoistością. Immunofluorescencja wykorzystuje immunoglobuliny IgG, które są rozpuszczalne w surowicy krwi.
Przeciwciała to cząsteczki do 950 kDa złożone z dwóch krótkich peptydów (światło) i dwóch długości w postaci „y” (ciężkich). Zarówno lekkie, jak i ciężkie łańcuchy są podzielone na dwie domeny: jedna zmienna, zdolna do rozpoznania antygenu, a druga stała lub zachowana, charakterystyczna dla każdego gatunku.
Antygeny są funkcjonalnie zdefiniowane jako cząsteczki, które mogą być rozpoznane przez przeciwciało i są głównie białkami. Gdy zwierzę jest narażone na antygen, limfocyty układu odpornościowego są aktywowane, wytwarzając określone przeciwciała przeciwko IT.
Na przykład antygen, taki jak białko, może mieć więcej niż jeden epitop lub miejsce rozpoznawania przeciwciała, więc surowica zwierzęcia narażona na antygen może mieć przeciwciała poliklonalne w stosunku do różnych regionów tego samego białka.
Może ci służyć: naskórka cebuliImmunofluorescencja wykorzystuje zatem zdolność zwierzęcia do wytwarzania przeciwciał poliklonalnych przeciwko konkretnemu antygenowi w celu jego oczyszczania, a następnie użycia go do wykrywania tego samego antygenu w innych kontekstach.
Wśród najczęściej stosowanych barwników lub cząsteczek fluorescencyjnych dla niektórych technik immunofluorescencyjnych są izootiocyjanian fluoresceiny (FITC), tetrametylrodoamin-5 i 6 (TRITC) izochianian, wiele cyjanin, takich jak Cy2, Cy3, Cy5 i Cy7 i barwniki zwane Alexa Fluor®, takie jak Alexa Fluor®, takie jak Alexa Fluor®, takie jak Alexa Fluor®448.
Protokół
Protokół immunofluorescencyjny różni się w zależności od wielu czynników, jednak ogólnie obejmuje liniową sekwencję kroków polegających na:
- Przygotowanie arkuszy i komórek
- Próbka fiksacja
- Permeabilizacja
- Bloking
- Immunotive lub immunomarcaje
- Montaż i obserwacja
-Przygotowanie
Próbek
Przygotowanie próbek będzie zależeć od ich natury i rodzaju doświadczenia, które należy przeprowadzić. Następnie zostanie wyjaśniony najprostszy przypadek, co implikuje zastosowanie zawieszonych komórek.
Komórki zawieszenia, czyli w ciekłej pożywce hodowlanej, należy najpierw oddzielić od tego przez wirowanie, a następnie należy je umyć roztworem buforowym lub „”bufor" Isosmotic, który zachowuje jego integralność.
Zwykle stosuje się bufor fosforanowo-solinowy znany jako PBS, w którym komórki są zawieszone.
Arkuszy
Arkusze używane do obserwacji mikroskopowej, w których komórki będą ustawione dla odpowiednich zabiegów poniżej, należy również starannie przygotować.
Są one pokryte lub „uczulone” roztworem polisiny, syntetycznym polimerem, który będzie służyć jako „klej molekularny” między komórkami a stałym wsparciem, dzięki interakcji elektrostatycznej między dodatnimi ładunkami ich grup aminowych i ujemnym obciążeniami białek pokrywających komórki.
Próbka fiksacja
Proces ten polega na unieruchomieniu białek, które znajdują się we wnętrzu komórkowym, aby utrzymać nienaruszoną lokalizację przestrzenną. Zastosowane cząsteczki powinny być w stanie przekraczać wszystkie rodzaje błon komórkowych i tworzyć ramki z kowalencyjnymi białkami.
Powszechnie stosuje się formaldehyd i paraformaldehyd, glutaraldehyd, a nawet metanol, z którymi próbki komórek są inkubowane przez określony czas, a następnie mycie ich izosmotycznym roztworem buforowym.
Po utrwaleniu komórek nadal łączy się z nimi do wcześniej uwrażliwionych arkuszy z polisiny.
Permeabilizacja
W zależności od rodzaju przeprowadzonego testu, konieczne będzie przepuszczanie lub nie badane komórki. Jeśli poszukiwane jest znanie lokalizacji, obecności lub nieobecności, pewnego białka na powierzchni komórki, permeabilizacja nie będzie konieczna.
Może ci służyć: fosfatydyloinozytol: struktura, trening, funkcjeZ drugiej strony, jeśli chcesz poznać lokalizację białka wewnątrz wnętrza komórkowego, permeabilizacja jest niezbędna i będzie składać się z inkubacji próbek z Triton X-100, detergentu zdolnym do permeabilizujących błon komórkowych.
Bloking
Blokowanie fundamentalnego etapu wszystkich technik immunologicznych. Na tym etapie procedury blokada składa się z pokrycia, w uwrażliwionych arkuszach, wszystkie miejsca z cząsteczkami poliesowymi, do których komórki nie były przylegane. To znaczy zapobiega jakimkolwiek niespecyficznym związkowi.
Zwykle do blokowania rozwiązań z albuminą serwatki bydlęcej (BSA) są stosowane w buforze PBS i najlepsze wyniki są uzyskiwane, im dłuższy czas inkubacji z tym rozwiązaniem. Po każdym etapie, w tym blokadzie, konieczne jest usunięcie pozostałego rozwiązania przez mycie.
Immunotive lub immunomarcaje
Procedura immunomaryzacji lub immunomandyczności będzie zależeć głównie, jeśli jest to bezpośrednia lub pośrednia immunofluorescencja (patrz później).
Jeśli jest to pierwotna lub bezpośrednia immunofluorescencja, próbki zostaną inkubowane z pożądanymi przeciwciałami, które muszą być sprzężone z barwnikami fluorescencyjnymi. Procedura inkubacji polega na rozcieńczeniu przeciwciała w roztworze, które BSA będzie również zawierać, ale w niższym proporcji.
Gdy sprawa jest wtórna lub pośrednia immunofluorescencja, należy dokonać dwóch kolejnych inkubacji. Najpierw z pożądanymi przeciwciałami, a następnie przeciwciałami, które są w stanie wykryć stałe obszary pierwotnych immunoglobulin. To te wtórne przeciwciała, które są zjednoczone kowalencyjnie z fluoroforami.
Technika jest bardzo wszechstronna, umożliwiając jednoczesne znaki więcej niż jednego antygenu na próbkę, o ile mają one pierwotne przeciwciała sprzężone z różnymi fluoroforami, w przypadku bezpośredniej immunofluorescencji.
W przypadku jednoczesnych znaków w pośredniej immunofluorescencji konieczne jest.
Podobnie jak blokada, inkubacja z przeciwciałami daje lepsze wyniki, tym większy czas tego czasu. Po każdym kroku konieczne jest umycie nadmiaru przeciwciał, które nie dołączyły do próbek, a w wtórnej immunofluorescencji należy zablokować przed dodaniem wtórnego przeciwciała.
Niektóre techniki wykorzystują inne barwniki, które nie mają nic wspólnego z immunomandycznością, takie jak barwienie jądrowe DNA za pomocą fluoroforu DAPI.
Montaż i obserwacja
Podczas ostatniego czasu inkubacji z fluoroforami konieczne jest, aby próbki pozostały w ciemności. W przypadku obserwacji mikroskopu jest to powszechne.
Chłopaki
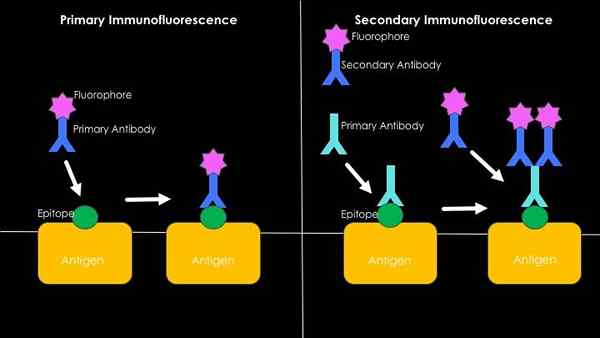 Podsumowanie graficzne bezpośredniej i pośredniej immunofluorescencji (źródło: WestHayl618 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Podsumowanie graficzne bezpośredniej i pośredniej immunofluorescencji (źródło: WestHayl618 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Bezpośrednia lub pierwotna immunofluorescencja
Ma to związek z wykrywaniem antygenów poprzez zastosowanie przeciwciał fluorescencyjnych. Główną zaletą zastosowania tej techniki jest jednak jej szybkość, jednak w tym procesie może wystąpić wiele przypadków niespecyficznego związku, szczególnie podczas badania ludzkich surowic, ponieważ są bogate w bardzo heterogeniczne przeciwciała przeciwciała.
Może ci służyć: 5 gałęzi głównej biotechnologiiPośrednia lub wtórna immunofluorescencja
Jest również znany jako technika „kanapka”, co implikuje opracowanie techniki w dwóch krokach. Pierwszy ma związek z użyciem niefluorescencyjnego przeciwciała i jego zjednoczenia z interesującym antygenem.
Przeciw stałego regionu tego pierwszego przeciwciała (który teraz będzie służył jako antygen) drugie przeciwciało zdolne do rozpoznania, które jest stosowane, które jest związane z cząsteczką fluorescencyjną.
Pojawienie się sygnału fluorescencyjnego będzie wynikiem specyficznego rozpoznania między pierwszym niefluorescencyjnym przeciwciałem a antygenem zainteresowanym; Obecność tego pierwszych warunków przeciwciał w drugim, które jest znakowane i dzięki którym można określić obecność lub brak antygenu.
Pomimo tego, że jest techniką, która zużywa znacznie dłużej niż bezpośrednia immunofluorescencja (ponieważ obejmuje bardziej etap inkubacji), technika ta nie oznacza projektowania przeciwciała fluorescencyjnego dla każdego badanego antygen.
Ponadto jest to bardziej wrażliwa technika pod względem amplifikacji sygnału, ponieważ więcej niż jedno wtórne przeciwciało może łączyć stały region pierwotnego przeciwciała, wzmacniając w ten sposób intensywność sygnału fluorescencyjnego.
Aplikacje
Jak wcześniej zauważono, immunofluorescencja jest niezwykle wszechstronną techniką, do której podano mnogość zastosowań w dziedzinach naukowych i klinicznych. Można go użyć do odpowiedzi na pytania ekologiczne, genetyczne i fizjologiczne dotyczące wielu organizmów.
Wśród zastosowań klinicznych stosuje się go do bezpośredniej diagnozy niektórych chorób dermatologicznych, czy to zastosowania bezpośredniej lub pośredniej immunofluorescencji na tkance nabłonkowej badanych pacjentów.
Techniki immunofluorescencyjne zostały ułożone w organizmach jednokomórkowych, takich jak drożdże do wizualizacji mikrotubul wewnątrzjądrowych i cytoplazmatycznych, aktyny i związanych z nimi białek, włókna 10 nm i inne składniki cytoplazmy, błony i ścian komórkowych.
Bibliografia
- ABCAM, Immunocytochemia i protokół immunofluorescencyjny. Pobrano z Abcam.com
- Graph, c. (2012). Fluorescencyjne barwniki. Pobrano z Leica-Microsystems.com
- Miller, d. M., & Shakest, D. C. (1995). Mikroskopia immunofluorescencyjna. W Metody w biologii komórkowej (Tom. 48, pp. 365-394). Academic Press, Inc.
- Odell, ja. D., & Cook, D. (2013). Techniki immunofluorescencyjne. Journal of Investigative Dermatology, 133, 1-4.
- Prince, ur. J. R., Adams, a. I. M., Druain, d. G., I Brian, K. (1991). Metody immunofluorescencyjne dla YEA. W Metody enzymologii (Tom. 194, s. 565-602). Academic Press, Inc.
- Schaeffer, m., Orsi, e. V, i Widelock, D. (1964). Zastosowania immunoflorence w wirusologii zdrowia publicznego. Recenzje bakteriologiczne, 28(4), 402-408.
- Vrieling, e. G., & Anderson, D. M. (1996). Immunofluorescencja w badaniach fitoplanktonu: zastosowania i potencjał. J: Phycol., 32, 1-16.
- « Prędkość areolowa sposób, w jaki jest obliczane i rozwiązane ćwiczenia
- Rząd Alberto Fujimori Pierwszy i drugi rząd »

