Znaczenie okresowych tabeli 8 powodów
- 4955
- 61
- Bertrand Zawadzki
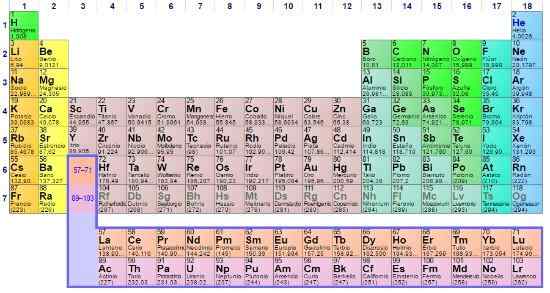
Znaczenie stolika okresowego Jest niezaprzeczalny z powodu prostego faktu, że przez ponad sto lat wspierał naukowców w zamawianiu wszystkich elementów chemicznych i będzie to robić przez resztę ludzkiej egzystencji. Jest to rodzaj budynku z bazami eksperymentalnymi i teoretycznymi, które podsumowują właściwości znanej materii.
Chociaż kilka modeli zostało opracowanych przed okresowym tabelą rosyjskiego chemika Dmitri Mendeleev, cel zawsze był taki sam: porządek, zlokalizuj i przewiduj elementy chemiczne, które dzielą właściwości wspólne. Zatem pozycje lub pudełka tej tabeli ujawniają więcej informacji niż można przeprowadzić wywiad z nagim okiem.
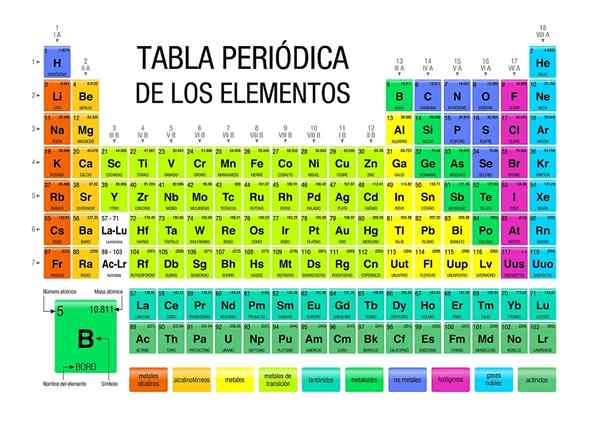 Tabela okresowa jest ikoną i narzędziem naukowym, w którym zbieżą się chemia, fizyka, historia i literatura
Tabela okresowa jest ikoną i narzędziem naukowym, w którym zbieżą się chemia, fizyka, historia i literatura Tabela okresowa jest obecna na wszystkich poziomach szkolenia akademickiego, a nawet ikona wiedzy ogólnej. Chociaż jest to niezbędne w chemii, prawda jest taka, że jest to również ważne w fizyce i biologii, oprócz tego, że jest źródłem studiów i inspiracji dla miłośników historii i literatury.
Dlatego niektóre z powodów, dla których stół okresowy jest ważny.
Jakie jest znaczenie okresowej tabeli?
Możesz podać różne powody, które wyjaśniają znaczenie tego narzędzia naukowego:
Jest to podstawa chemii nieorganicznej

Chemia nieorganiczna jest praktycznie badaniem stolika okresowego. Bez tego cała wiedza osiągnięta na temat tego rodzaju materii spadnie. Ci, którzy są oddani tej gałęzi chemii, ważne jest, aby mogli odczytać i wyodrębnić wszystkie informacje, które oferuje ta tabela na temat elementów chemicznych poza węglem i jego izotopami.
W przypadku chemikaliów organicznych wiele razy spójrz po prawej stronie stolika okresowego: dokładniej w kierunku górnej części bloku P, gdzie znajduje się węgiel i kilka nieMetali.
Może ci służyć: TritioZ drugiej strony chemicy nieorganiczni muszą przejrzeć wszystkie metale, które tworzą bloki D I F, a także grupa 18 gazów szlachetnych, więc w końcu zapoznają się ze wszystkimi pierwiastkami chemicznymi; Z wyjątkiem być może syntetycznych i wysoce radioaktywnych.
Rzucić światło na wiedzę chemiczną
Przed stołem okresowym i pierwszymi próbami zamówienia pierwiastków chemicznych w oparciu o jego podobieństwa, chemia została owinięta niepewną aurą i mistycyzmem.
Nikt nie wiedział dokładnie, ile lub które były wszystkie elementy chemiczne, które mogłyby istnieć w naturze. Dzięki temu stołowi wiadomo dzisiaj, że mamy maksymalnie 118 elementów. To, co wcześniej wydawało się ciemne, teraz jest jasne, zrozumiałe i zorganizowane.
Pozwala na przewidywanie właściwości nowych elementów
Na początku stół okresowy zawierał puste przestrzenie, ponieważ do tego czasu nie odkryto kilku elementów chemicznych.
Lokalizacje tych przestrzeni wskazywały, że nowy element, zgodnie z rówieśnikami, musiał reagować podobnie; Co więcej, można go nawet znaleźć w tych samych źródłach mineralnych.
I w rzeczywistości w chemicznym obróbce symfin mineralnych, w których powoli odkryto brakujące pierwiastki chemiczne; Na przykład galum, german i scandio. Gala, która ma być pod aluminium, musiał dzielić właściwości z tymi ostatnimi i tworzyć minerały (tlenki, siarki, chlorki itp.) Ten sam typ.
Gdyby utworzono element 119, koniecznie musiałby znajdować się poniżej Francio, w grupie 1; a zatem reaguj lub mają właściwości chemiczne podobne do innych metali alkalicznych (lit, sód, potas itp.).
Może ci służyć: współczynnik rozcieńczeniaRóżnica i klasyfikuj pierwiastki chemiczne
W tabeli okresowej można zaobserwować, w jaki sposób elementy są klasyfikowane i dostępne w określonych obszarach lub grupach. Na przykład nie -metal są zorientowane w prawo w prawym górnym rogu.
Tymczasem metale, które stanowią większość elementów, integrują lewą stronę i środek tabeli, a także blok F: Te dwa rzędy poniżej.
Każda grupa wymieniona od 1 do 18. Te z grupy 1 nazywane są metali alkalicznych, te z grupy 2, metali alkaliczne, te z 3, grupy Scandio i tak dalej. Niektóre grupy mają unikalne nazwy, takie jak grupa 16 lub tlen, zwany calcogenami lub amfumami.
Przechowuj ogromne ilości informacji
W okresowych tabelach możemy zobaczyć liczby utleniania dla każdego pierwiastka, ich energie jonizacji, średniej masy atomowej, jej konfiguracji elektroonetywiczności i całego zestawu jego właściwości okresowych.
Ponadto w niektórych tabelach można nawet znaleźć informacje o jego normalnych punktach fuzji i wrzenia, a także o krystalicznych strukturach jego stałych. W tym sensie pojawiają się bardziej wyspecjalizowane okresowe tabele niż inne, w zależności od pracy i poziomów akademickich.
Wyjaśnia okresowe trendy
Podążając za grupami i szeregami stolika okresowego, możliwe jest wyraźnie obserwowanie, jak zmieniają się właściwości okresowe, gdy przechodzimy z jednego elementu do drugiego.
Na przykład promień atomowy maleje w całym rzędzie, od lewej do prawej, ale wzrasta, gdy schodzimy przez grupę. Ponadto charakter metaliczny wzrasta od góry do dołu i od prawej do lewej.
Przewiduje charakter powstałych związków
Związki powstają, gdy dwa lub więcej elementów reagują na siebie. W zależności od ich odpowiednich pozycji w tabeli okresowej, możliwe jest przewidzieć, jaki będzie chemiczny charakter tego związku.
Może ci służyć: bromek wodoru (HBR)Na przykład, jeśli metalowy chlor sodu i gaz. Wynika to z faktu, że sód jest metalem, podczas gdy chlor A Non -Metal, którego różnice między jego elektroetronegatycznością są duże, faworyzując w ten sposób tworzenie związku jonowego.
To okno do historii nauki
 Maria Curie
Maria Curie Każdy element ma swoją historię i odkrywców. Ich zwykłe nazwy to odruchy lub te, które je odkryli, z regionów geograficznych, w których zostały wyodrębnione w swoich czystych formach lub charakterystyczny kolor ich minerałów. Na przykład gaz helowy zawdzięcza swoją nazwę właśnie dlatego, że został zidentyfikowany na słońcu.
W okresowym stole widzimy kawałek życia Antoine Lavoisier, Marie Curie, Carl Willhelm Scheele, Henry Cavendish, Paul Emile Lecog i wielu innych naukowców, którzy przyczynili się do ukończenia stołu podczas odkrywania nowych elementów chemicznych.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Helmestine, Anne Marie, pH.D. (11 lutego 2020). Dlaczego tabela okresu jest ważna? Odzyskane z: Thoughtco.com
- Ben p. Stein. (28 maja 2019). Tabela okresowa: to coś więcej niż tylko chemia i fizyka. Odzyskane z: NIST.Gov
- Dennis Rouvray. (10 stycznia 2019). Tabela okresu była najważniejszym przełomem chemii. New Scientist Ltd. Odzyskane z: Newscientist.com
- Wanda Thibodeaux. (26 kwietnia 2018 r.). Znaczenie stolika okresowego. Odzyskane z: naukowe.com

