Struktura wodorotlenku magnezu, właściwości, nomenklatura,

- 2719
- 582
- Prokul Woliński
On wodorotlenek magnezu Jest to związek nieorganiczny, którego wzorem chemicznym jest Mg (OH)2. W swojej czystej postaci jest białą substancją stałą bez jasności i amorficznego wyglądu; Jednak przy niewielkiej i dokładnej zawartości zanieczyszczeń jest przekształcana w krystaliczną stałą Bucitę, minerał, który jest w niektórych osadach w naturze i jest bogatym źródłem magnezu.
Jest to słaby elektrolit lub podstawa, więc jego dysocjacja jest niska w wodzie. Ta właściwość sprawia, że MG (OH)2 dobry neutralizator kwasowości do konsumpcji człowieka; Popularnie znany środek zaradczy jako zawiesina mleka z Magnezji. Jest to również opóźnienie przeciwpożarowe poprzez uwalnianie wody podczas jej rozkładu termicznego.
 Próbka wodorotlenku stałego magnezu. Źródło: Chemicalinterest [domena publiczna]
Próbka wodorotlenku stałego magnezu. Źródło: Chemicalinterest [domena publiczna] Na górnym obrazie pokazano niektóre substancje stałe wodorotlenku magnezu, w którym widać jego nieprzezroczysty biały kolor. Im bardziej krystaliczne są, rozwijają szkliste i perłowe powierzchnie.
Jego krystaliczna struktura jest specyficzna, ponieważ ustanawia podwójnie warstwy sześciokątne, które są obiecującymi projektami projektowania nowych materiałów. W tych warstwach ich dodatnie obciążenia odgrywają ważną rolę ze względu na wymianę MG2+ przez trójwartościowe kationów i gatunku ograniczonym między ścianami złożonymi ze anionów oh-.
Z drugiej strony inne zastosowania pochodzą w zależności od morfologii przygotowanych cząstek lub nanocząstek; jako katalizatory lub adsorbenty. We wszystkich z nich stosunek 1: 2 dla jonów Mg jest stały2+: Oh-, odbijane w tej samej wzorze Mg (OH)2.
[TOC]
Struktura
Formuła i Octaedro
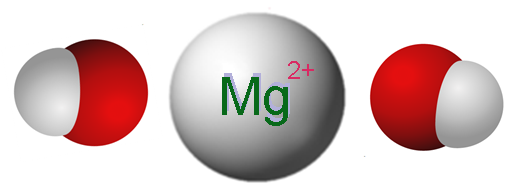 Jony składające się z wodorotlenku magnezu. Źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Jony składające się z wodorotlenku magnezu. Źródło: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Najwyższy obraz pokazuje jony, które składają się na MG (OH)2. Jak widać, są dwa aniony oh- Dla każdego kationu mg2+, które oddziałują elektrostatycznie w celu zdefiniowania kryształu sześciokątnej. Ta sama formuła wskazuje, że stosunek Mg: OH wynosi 1: 2.
Jednak prawdziwa struktura krystaliczna jest nieco bardziej skomplikowana niż zakładanie prostych jonów Mg2+ I och-. W rzeczywistości magnez charakteryzuje się posiadaniem liczby koordynacji 6, dzięki czemu może oddziaływać z maksymalnie sześcioma OH-.
W ten sposób powstaje oktahedron MG (OH)6, gdzie atomy tlenu oczywiście pochodzą z OH-; a krystaliczna struktura opiera się teraz na rozważaniu takich oktahedry i ich interakcji.
W rzeczywistości jednostki MG (OH)6 Ostatecznie definiują struktury podwójnie warstwy, które z kolei są uporządkowane w kosmosie, aby spowodować sześciokątny szkło.
Może ci służyć: waga atomowaPodwójna warstwa
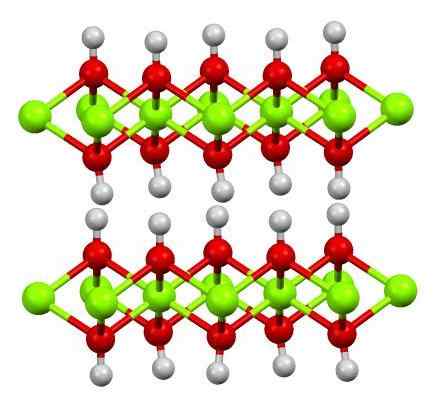 Podwójna warstwa wodorotlenku magnezu. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
Podwójna warstwa wodorotlenku magnezu. Źródło: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Górny obraz pokazuje podwójną warstwę wodorotlenku magnezu (LDH) Warstwowe podwójne wodorotlenki). Zielone kule reprezentują jony MG2+, które można zastąpić innymi o większym obciążeniu, aby wygenerować dodatnie obciążenie w warstwie.
Zauważ, że wokół każdego Mg2+ Istnieje sześć czerwonych kulek związanych z ich odpowiednimi białymi kulami; to znaczy jednostki ośmiadralne Mg (OH)6. OH- Działa jak most, aby dołączyć do dwóch mg2+ różnych samolotów, co sprawia, że warstwy są ograniczone.
Podobnie obserwuje się, że atomy wodoru wskazują w górę iw dół i są pierwszymi odpowiedzialnymi za siły międzycząsteczkowe, aby utrzymać dwie warstwy jednostek Mg (OH) razem6.
Wśród tych warstw neutralne cząsteczki (takie jak alkohole, amoniak i azot) lub nawet aniony, w zależności od ich pozytywnych (jeśli istnieją jony3+ lub wiara3+ zastąpienie Mg2+). „Wypełnianie” tych gatunków ogranicza się powierzchnie złożone z OH Aniony-.
Morfologie
Szkło sześciokątne i podwójnie warstwy rośnie powoli lub szybko. Wszystko zależy od parametrów syntezy lub przygotowania: temperatury, relacji molowej, pobudzenia, rozpuszczalników, odczynników jako źródła magnezu, zasad lub środków wytrącających się itp. W miarę wzrostu szkła zdefiniuj mikrostrukturę lub morfologię jej nanocząstek lub agregatów.
Zatem te nanocząstki mogą mieć naczynia, płytki krwi lub kalafior. Podobnie rozkład jego rozmiarów może się zmienić, a także stopień porowatości powstałych ciał stałych.
Nieruchomości
Wygląd fizyczny
Jest to biała, granulowana lub sproszkowana stała i toaleta.
Masa cząsteczkowa
58 3197 g/mol.
Gęstość
3,47 g/ml.
Temperatura topnienia
350 ° C. W tej temperaturze rozkłada się w tlenku, uwalniając cząsteczki wody zawarte w ich kryształach:
Mg (OH)2(s) => MGO (s) +h2O (g)
Rozpuszczalność wody
0,004 g/100 ml w 100 ° C; Oznacza to, że ledwo udaje się rozpuścić we wrzącej wodzie, więc jest to nierozpuszczalny związek w wodzie. Jednak przez zmniejszenie pH (lub zwiększenie kwasowości) jego rozpuszczalność jest zwiększona przez tworzenie złożonego acuo, mg (OH2)6.
Z drugiej strony, jeśli MG (OH)2 wchłonął CO2, Uwolni gaz zatrzymany jako musowanie podczas rozpuszczania w kwaśnej pożywce.
Może ci służyć: hel: historia, właściwości, struktura, ryzyko, użyciaWspółczynnik załamania światła
1559
Ph
Wodne zawieszenie ma pH, które waha się między 9,5 a 10,5. Chociaż wartości te są normalne, odzwierciedla jego niewielką zasadowość wobec innych wodorotlenków metali (takich jak NaOH).
Pojemność cieplna
77.03 J/mol · k
Gdzie to się znajduje?
 Blue Blucita Blue Blut. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Blue Blucita Blue Blut. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Wodorotlenek magnezu można znaleźć w naturze jako minerał Brucita, który charakteryzuje się jego przezroczystym białym kolorem, z zielonymi lub niebieskawymi tonami w zależności od jego zanieczyszczeń. Podobnie Bucita jest częścią niektórych glin, takich jak chloryn, gdy przeplatanie się między warstwami krzemian, połączonych przez jony metalu.
W La Brucita są inne jony oprócz MG2+, Jak Al3+, Wiara3+, Zn2+ i Mn2+. Ich menas można znaleźć w różnych regionach lub jeziorach Szkocji, Kanady, Włoch i USA.
Fizycznie ich kryształy widzą.
Ten minerał jest jednym ze zła, które wpływają na cementy i beton, ponieważ ma tendencję do rozszerzania się i powodowania w nich złamań. Jednak nie pochłania CO2, Zatem jego kalcynacja nie przyczynia się do efektu cieplarnianego, a zatem jest to odpowiednie źródło mineralogiczne (i najbogatsze) do uzyskania magnezu, oprócz wody morskiej.
Nomenklatura
MG (OH)2 Ma do trzech nazwisk zaakceptowanych przez IUPAC (poza mineralogią lub medycyną). Są one bardzo podobne do siebie, ponieważ tak jak się kończą.
Na przykład „wodorotlenek magnezu” odpowiada jego nazwie według nomenklatury zapasowej, pomijając (ii) na końcu, ponieważ +2 jest prawie domyślnie jedynym stanem utleniania magnezu.
„Dihydroksydle magnezu”, wskazując z prefiksem greckim- wskazane w wzorze zgodnie z systematyczną nomenklaturą. I „wodorotlenek magnetyczny”, kończący się na sufiks -ico do bycia maksymalnym i „unikalnym” stanem utleniania magnezu, zgodnie z tradycyjną nomenklaturą.
Pozostałe nazwy, takie jak Brucita lub Milsia Mleko, chociaż są one bezpośrednio związane z tym związkiem, nie jest wygodne odwołanie się do niego, jeśli chodzi o jego najczystszą substancję stałą lub jako związek nieorganiczny (odczynnik, surowiec itp.).
Aplikacje
Neutralizator
MG (OH)2 Ze względu na niską rozpuszczalność w wodzie fakt, że jest to doskonały neutralizator kwasowości; W przeciwnym razie medium oparłoby się, przyczyniając się do dużych stężeń jonów OH-, jak robią to inne podstawy (mocne elektrolity).
Może ci służyć: hybrydyzacja chemicznaZatem MG (OH)2 ledwo uwolnij OH-, Jednocześnie reaguje z jonami H3ALBO+ Tworząc kompleks magnezu, również wspomniany powyżej. Możliwość zneutralizowania kwasowości środowisk wodnych, jest przeznaczony do oczyszczania ścieków.
Jest to również dodatek żywności, nawozów i niektórych produktów higieny osobistej, takich jak pasta do zębów, ponieważ jej kwasowość maleje.
Zobojętnienie
Będąc mało rozpuszczalnym w wodzie, można go brać bez ryzyka skutków jego jonów OH- (bardzo mało dysocjacji jak słaby elektrolit).
Ta charakterystyka, powiązana z podczęścią z góry, czyni zobojętnieniem do leczenia kwasowości żołądka, chorób żołądkowo -jelitowych, niestrawności i zaparć, sprzedawanych pod wzorem mleka magnezji.
Z drugiej strony mleko magnezji pomaga również zwalczyć irytujące fasety (białe i zaczerwienione rany, które pojawiają się w jamie ustnej).
Ognioodporny
W sekcji nieruchomości wspomniano, że MG (OH)2 Rozkłada uwalnianie wody. Dokładnie taka woda pomaga zatrzymać postęp płomieni, ponieważ wchłaniają ciepło do odparowania, a z kolei opary rozcieńczają palące lub łatwopalne gazy.
Minerał Brucita jest zwykle używany w tym celu przemysłowo, przeznaczony jako wypełnienie niektórych materiałów, takich jak tworzywa sztuczne różnych polimerów (PVC, żywice, gumy), kable lub sufity.
Katalizator
MG (OH)2 zsyntetyzowane jako Nanoplaquetas okazało się skuteczne w katalizowaniu redukcji chemicznych; Na przykład 4-nitrofenol (pH-no2) 4-aminofenol (pH-nh2). Mają także aktywność przeciwbakteryjną, więc można ją zastosować jako środek terapeutyczny.
Adsorbent
Niektóre stałe mg (oh)2 Mogą być dość porowate, w zależności od metody ich przygotowania. Dlatego uważają aplikację jako adsorbenty.
W roztworach wodnych mogą adsorbować (na swoich powierzchniach) cząsteczki kolorowania, wyjaśniając wodę. Na przykład są w stanie adsorbować barwnik Indigo Carmine obecny w prądach wodnych.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Magnez wodny. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2019). Magnez wodny. Baza danych Pubchem. CID = 14791. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Galerie Amethyst. (2014). Mineral Brucite. Odzyskane z: galerie.com
- Henrist i in. (2003). Badanie morfologiczne nanocząstek wodorotlenku magnezu
- wytrącone w rozcieńczonym roztworze wodnym. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad r. S. (2018). Synteza i analiza strukturalna mezoporowatych nanocząstek wodorotlenku magnezu jako skuteczny katalizator.
- Thimmasandra Narayan Ramesh i Vani Pavada Sreenivasa. (2015). Usunięcie barwu Indigo z wodnego roztworu przy użyciu wodorotlenku magnezu jako adsorbentu. Journal of Materials, vol. 2015, identyfikator artykułu 753057, 10 stron. doi.Org/10.1155/2015/753057
- « Historia niklu, właściwości, struktura, zastosowania, ryzyko
- Biografia Chamber Carlos Pellicer, styl, prace, frazy »

