Struktura wodorotlenku miedzi (ii), właściwości, nomenklatura,

- 4858
- 112
- Eugenia Czapla
On wodorotlenek miedzi (ii) o Wodorotlenek miedzi to zielonkawo -niebieski lub niebieski krystaliczny nieorganiczny stał2. Uzyskuje się go jako błękitne obszerne osad przez dodanie wodorotlenku alkalicznego do roztworów cupric (oznacza to, że zawierają jony cu2+). Jest to niestabilny związek.
Aby zwiększyć swoją stabilność, jest on przygotowywany w obecności amoniaku (NH3) lub fosforany.Jeśli przygotowuje się w obecności amoniaku, istnieje materiał o dobrej stabilności i dużej wielkości cząstek.
 Próbka wodorotlenku miedzi, Cu (OH)2. Samzane na Włoskiej Wikipedii [domena publiczna] Źródło: Wikipedia Commons
Próbka wodorotlenku miedzi, Cu (OH)2. Samzane na Włoskiej Wikipedii [domena publiczna] Źródło: Wikipedia Commons Przygotowując się z fosforanem miedzi (II), Cu3(PO4)2, Uzyskuje się drobniejszy rozmiar cząstek i większą powierzchnię. Wodorotlenek miedziowy jest szeroko stosowany jako fungicydy i bakteriobójstwo w rolnictwie oraz do leczenia drewna, przedłużając jego okres użytkowania.
Jest również stosowany jako suplement ds. Żywności dla zwierząt. Jest stosowany jako surowiec do uzyskania innych soli miedzianych (ii) i w galwanoplastyce do pokrycia powierzchni.
Badania są przeprowadzane w celu oszacowania ich potencjału zwalczania infekcji bakteryjnych i grzybiczych w ludzkiej istocie.
[TOC]
Struktura
Wodorotlenek miedzi (II) zawiera nieskończone jony miedzi (Cu2+) Zjednoczone dla grup hydroksylowych (OH-).
Łańcuchy są tak zapakowane, że 2 atomy tlenu z innych łańcuchów znajdują się powyżej i poniżej każdego atomu miedzi, a następnie przyjmują zniekształconą konfigurację oktaedryczną, która jest powszechna w większości związków miedzianych (II).
W swojej strukturze cztery atomy tlenu znajdują się w odległości 1,93 A; Dwa atomy tlenu to 2,63 A; A odległość Cu-CU wynosi 2,95 do.
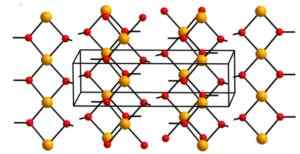 Krystaliczna struktura wodorotlenku miedzi. Aleksandar Kondiński [CC BY-SA.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikipedia Commons
Krystaliczna struktura wodorotlenku miedzi. Aleksandar Kondiński [CC BY-SA.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikipedia Commons Nomenklatura
- Wodorotlenek miedzi (ii).
- Wodorotlenek miedzi.
- Miedziany dihydroksyd.
Nieruchomości
Stan fizyczny
Krystaliczne ciało stałe.
Waga molekularna
99,58 g/mol.
Temperatura topnienia
Załamuje się przed topieniem. Punkt degradacji 229 ºC.
Może ci służyć: 25 przykładów rozpuszczalności w życiu codziennymGęstość
3,37 g/cm3
Rozpuszczalność
Jest praktycznie nierozpuszczalny w wodzie: 2,9 mikrogramy/L A 25 ° C. Szybko rozpuszczalne w kwasach, w stężonych roztworach alkalicznych i wodorotlenku amonu. Nierozpuszczalne w rozpuszczalnikach organicznych. W gorącej wodzie rozkłada się wytwarzanie tlenku miedzi (II), co jest bardziej stabilne.
Inne właściwości
Jest łatwo rozpuszczalny w silnych kwasach, a także w skoncentrowanych alkalicznych roztworach wodorotlenków, aby dać głębokie aniony niebieskie, prawdopodobnie typ [cuN(OH)2n+2]2-.
Jego stabilność zależy od metody przygotowania.
Można go rozbić, podając tlenek miedzi (ii) czarny (CUO), jeśli pozostaje w spoczynku lub niskim ogrzewaniu.
W obecności nadmiaru alkalicznego rozkłada się ponad 50 ° C.
Aplikacje
W rolnictwie
Wodorotlenek miedzi (II) ma szerokie zastosowanie jako grzybobójcze i przeciwbakteryjne w uprawach rolniczych. Oto kilka przykładów:
- Służy przeciwko miejscom bakteryjnym ( Erwinia) W sałaty, stosując się jako leczenie dolistne.
- Przeciwko punktom bakteryjnym (of Xanthomonas pruni) W brzoskwiniach, dla których stosuje się utajone i dolistne leczenie.
- Jest używany na arkuszu i łodydze jagód przez ukryte zastosowania.
- Przeciwko zgnilicy podczas przechowywania jagód spowodowanych przez Monilinia Oxycocci, przez utajoną aplikację.
Do zastosowania w rolnictwie stosuje się wodorotlenek miedzi (II), który jest przygotowywany w obecności fosforanów ze względu na jego mały rozmiar cząstek.
 Uprawa sałaty. Źródło: Pixabay
Uprawa sałaty. Źródło: Pixabay W zachowaniu drewna
Drewno z powodu natury organicznej jest wrażliwe na atak owadów i mikroorganizmów. Wodorotlenek miedzi (II) jest używany jako biobójstwo grzybów atakujących drewno.
Jest zwykle stosowany obok czwartorzędowego związku amonu (NH4+). Wodorotlenek miedzi działa jak grzybobójstwo, a czwartorzędowy związek amoniowy działa jako owadobójczy.
W ten sposób traktowane drewno trwa lub opiera się na warunkach usług, osiągając wymagany poziom wydajności użytkownika. Jednak drewno traktowane tymi związkami ma wysoki poziom miedzi i jest bardzo żrący dla wspólnej stali, więc wymagany jest rodzaj stali nierdzewnej, która może wytrzymać przetwarzanie obróbki drewna.
Może ci służyć: odwracalna reakcja: charakterystyka i przykładyPomimo przydatności wodorotlenek miedzi (II) jest uważany za nieco niebezpieczny biocyd.
Z tego powodu istnieje obawa, że jest on uwalniany z drewna traktowanego do środowiska w ilościach, które mogą być szkodliwe dla mikroorganizmów naturalnie obecnych w wodach (rzeki, jeziora, mokradła i morze) lub glebie).
W produkcji Rayóna
Od dziewiętnastego wieku zastosowano roztwory amoniaków wodorotlenku miedzi (II) do rozpuszczenia celulozy. Jest to jeden z pierwszych kroków w celu uzyskania światłowodów o nazwie Rayón poprzez technologię opracowaną przez Bemberga w Niemczech.
Wodorotlenek miedzi (II) rozpuszcza się w roztworze amoniaku (NH3), tworząc złożoną sól.
Krótkie rafinowane włókna bawełniane są dodawane do amoniakalnego roztworu miedzi zawierającego wodorotlenek miedzi (II) w postaci stałego stałego osadu.
Celluloza bawełniana tworzy kompleks z rozpuszczeniem wodorotlenku miedzi tetra-jamu w roztworze.
Następnie to rozwiązanie to koagula, przechodząc przez urządzenie wytłaczające.
Ze względu na wysokie koszty technologia ta została już pokonana przez Viscosa. Technologia Bemberga jest obecnie używana tylko w Japonii.
W branży zwierząt
Jest stosowany jako ślady w paszach dla zwierząt, ponieważ jest to jedna z substancji wymaganych jako mikroelementy do pełnego odżywiania zwierząt.
 Skoncentrowana żywność dla bydła. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons
Skoncentrowana żywność dla bydła. Thamizhpparithi Maari [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikipedia Commons Wynika to z faktu, że w wyższych istotach żywych miedź jest niezbędnym elementem, wymaganym do aktywności różnych enzymów zawierających miedź.
Na przykład jest zawarty w enzymie, który uczestniczy między innymi w produkcji kolagenu i enzymu wymaganego do syntezy melaniny.
Może ci służyć: aminyJest to związek ogólnie uznany za ubezpieczenie, gdy jest dodany do poziomów zgodnych z dobrą praktyką żywnościową.
 Mleczne krowy. Źródło: Pixabay
Mleczne krowy. Źródło: Pixabay W produkcji innych związków miedzianych (II)
Prekursor aktywny w produkcji następujących związków miedzi (ii): miedzi (ii), miedzi 2-fotylowo-egzanian (II) i mydła miedzi i mydła miedzi. W takich przypadkach stosuje się wodorotlenek miedzi (II), który jest syntetyzowany w obecności amoniaku.
Inne zastosowania
Jest stosowany w stabilizacji nylonu w elektrodach akumulatorów; jako utrwalacz kolorów w operacjach farbowania; jako pigment; w środkach owadobójczych; w leczeniu papierowym i barwieniu; W katalizatach, jako katalizator wulkanizacji gumy polisiarczkowej; jako pigment antynosowy; oraz w elektrolizy w galwanoplastyce.
Przyszłe zastosowania medyczne
Wodorotlenek miedzi (II) jest częścią związków miedzianych, które są badane w postaci nanocząstek do eliminacji bakterii, takich jak I. coli, K. Pneumoniae, s. 1. Aeruginosa, Salmonella spp., między innymi przyczyny chorób w ludziach.
Stwierdzono również, że nanocząstki miedzi mogą być skuteczne Candida albicans, Grzyb, który jest powszechną przyczyną ludzkich patologii.
Wskazuje to, że nanotechnologia miedzi może odgrywać ważną rolę wobec bakterii i grzybów powodujących zakażenia ludzkie, a wodorotlenek miedzi (II) może być bardzo przydatny w tych dziedzinach.
Bibliografia
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Kirk-Othmer (1994). Encyklopedia technologii chemicznej. Tom 7. Czwarta edycja. John Wiley & Sons.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). PIĄTA EDYCJA. Tom A7. VCH Verlagsgellschaft MBH.
- Dance, J.C.; Emeléus, godz.J.; Sir Ronald Nyholm i Trotman-Deckenson.F. (1973). Kompleksowa chemia nieorganiczna. Tom 3. Pergamon Press.
- National Library of Medicine. (2019). Miedź (ii) hydroksyde. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Schiopu, n. i Tiruta-Brana, L. (2012). Środki konserwujące drewno. W toksyczności materiałów do wzmocnienia. Rozdział 6. Odzyskane z naukowym.com.
- Mordorski, ur. i Friedman, aby. (2017). Nanocząstki metalu do infekcji drobnoustrojów. W funkcjonalizowanych nanomateriałach do leczenia infekcji drobnoustrojów. Rozdział 4. Odzyskane z naukowym.com.
- Takashi Tsurumi. (1994). Spinning rozwiązania. W zaawansowanej technologii wirowania światłowodowego. Rozdział 3. Odzyskane z naukowym.com.
- « Fundacja histochemii, przetwarzanie, barwienie
- Struktura tlenku cerio (iv), właściwości, zastosowania »

