Wodorotlenek baru (BA (OH) 2)

- 2003
- 43
- Bertrand Zawadzki
 Wodorotlenek baru jest stosowany do różnych celów w różnych branżach. Z licencją
Wodorotlenek baru jest stosowany do różnych celów w różnych branżach. Z licencją Co to jest wodorotlenek baru?
On wodorotlenek baru Jest to chemiczny związek wzoru BA (OH)2(H₂o)X. Jest silną zasadą i może być w kształcie bezwodnego, monohydratu lub octacynowania. Forma monohydowana, zwana również Barita agua, jest najczęstszym i komercyjnym zastosowaniem.
Wodorotlenek baru można przygotować przez rozpuszczenie tlenku baru (BAO) w wodzie: BAO + 9H2O → Ba (OH)2· 8H2ALBO. Krystalizuje się jak Octahydrate, który staje się monohydratem podczas ogrzewania w powietrzu. W 100 ° C pusty monohydrat wytwarza bao i wodę.
Właściwości wodorotlenku baru
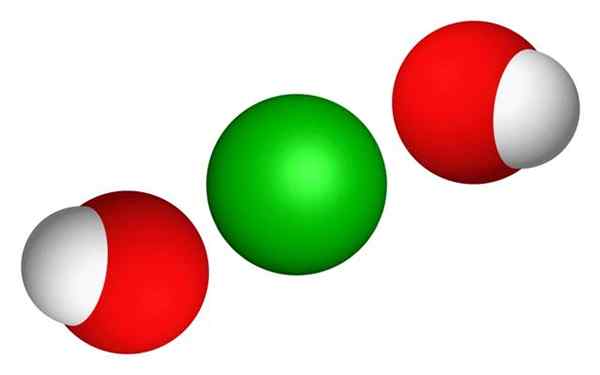 Struktura chemiczna 3D wodorotlenku baru. Domena publiczna, Wikimedia Commons.
Struktura chemiczna 3D wodorotlenku baru. Domena publiczna, Wikimedia Commons. - Wodorotlenek baru to biały lub przezroczysty kryształy oktahédic. Brak zapachu i żrącego smaku.
- Kształt anodra ma masę cząsteczkową 171,34 g/mol, gęstość 2,18 g/ml, temperaturę fuzji 407 ° C i temperaturę wrzenia 780 ° C.
- Monohydowany kształt ma masę cząsteczkową 189 355 g/mol, gęstość 3743 g/ml i temperaturę topnienia 300 ° C.
- Kształt Octohydrat ma masę cząsteczkową 315,46 g/mol, gęstość 2,18 g/ml i temperaturę topnienia 78 ° C.
- Związek jest lekko rozpuszczalny w wodzie i nierozpuszczalny w acetonie. Jest to silna podstawa z PKA 0,15 i 0,64 dla pierwszego i drugiego OH- odpowiednio.
- Wodorotlenek baru reaguje podobnie do wodorotlenku sodu (NaOH), ale jest mniej rozpuszczalny w wodzie.
- Zneutralizuje egzotermicznie kwasy, tworząc sole więcej wody.
- Może reagować z aluminium i cynkiem z tworzeniem tlenków metali lub wodorotlenków i generować wodorowe wodór.
- Możesz rozpocząć reakcje polimeryzacji w polimeryzowalnych związkach organicznych, zwłaszcza epoksydach.
- Może generować łatwopalne i/lub toksyczne gazo. Chlorowane mieszanki gumowe eksplodują, gdy są podgrzewane lub zmiażdżone.
Może ci służyć: rozcieńczone rozwiązanie- Wodorotlenek baru łamie się na tlenek baru, gdy jest ogrzewany w temperaturze 800 ° C. Reakcja dwutlenku węgla wytwarza węglan barowy. Jego wodny roztwór, wysoce alkaliczny, doświadcza reakcji neutralizacji kwasami. Zatem siarczan baru i fosforan barowy z kwasami siarkowymi i fosforowymi.
H2południowy zachód4 + BA (OH)2 Baso4 + 2h2ALBO
- Reakcja siarkowodoru wytwarza siarczk barowy. Wytrącanie wielu nierozpuszczalnych soli baru lub mniej rozpuszczalnych może wynikać z podwójnej reakcji zastępczej, gdy wodny roztwór wodorotlenku baru jest mieszany z wieloma roztworami z innych soli metali.
- Mieszanina uwodnionego wodorotlenku stałego z stałym chlorkiem amonicznym w zlewce powoduje reakcję endotermiczną do wytworzenia cieczy, z ewolucją amoniaku. Temperatura dramatycznie maleje do około -20ºC.
BA (OH)2 (s) + 2nh4Cl (y) → bacl2 (aq) + 2nh3 (g) + h2ALBO
- BA (OH) 2 reaguje z dwutlenek węgla do produkcji węglanu baru. Jest to wyrażone przez następującą reakcję chemiczną:
BA (OH) 2 + CO2 → BACO3 + H2O.
Reaktywność i niebezpieczeństwa
Wodorotlenek baru jest klasyfikowany jako stabilny związek bezfuelowy, który reaguje szybko i egzotermicznie z kwasami, jest niezgodny z dwutlenkiem węgla i wilgocią. Związek jest toksyczny i jako silna baza jest żrący.
Wdychanie, spożycie lub kontakt skóry z materiałem może powodować poważne obrażenia lub śmierć. Kontakt ze stopioną substancją może powodować ciężkie oparzenia skóry i oczu.
Efekty kontaktu lub inhalacji można opóźnić. Ogień może wytwarzać irytujące, żrące i/lub toksyczne gazy. Ścieki kontroli pożaru mogą być żrące i/lub toksyczne i powodować zanieczyszczenie.
Może ci służyć: kwasowe sole (oksisals)Kontakt wzrokowy
Jeśli związek zetknie się z oczami, soczewki kontaktowe należy sprawdzić i usunąć. Oczy z dużą ilością wody przez co najmniej 15 minut, z zimną wodą należy natychmiast umyć.
Kontakt ze skórą
W przypadku kontaktu ze skórą dotknięty obszar należy natychmiast spłukać przez co najmniej 15 minut z dużą ilością.
Umyj ubrania i buty, zanim ponownie ich użyjesz. Jeśli kontakt jest poważny, umyj mydłem dezynfekującym i przykryj skórę zanieczyszczoną kremem przeciwbakteryjnym.
Inhalacja
W przypadku inhalacji ofiara musi zostać przeniesiona do świeżego miejsca. Jeśli nie oddychasz, podaje się sztuczne oddychanie. Jeśli oddychanie jest trudne, zapewnij tlen.
Przyjmowanie pokarmu
Jeśli związek jest połknięty, nie należy indukować wymiotów. Luźne ciasne ubrania, takie jak szyja koszulka, pasek lub krawat.
We wszystkich przypadkach należy uzyskać natychmiastową opiekę medyczną.
Aplikacje
1. Przemysł
- Wodorotlenek baru jest stosowany jako prekursor innych związków barowych. Monohydrat jest stosowany do odwodnienia i eliminowania siarczanu z różnych produktów. To zastosowanie przemysłowe dotyczy również zastosowań laboratoryjnych.
- Jest stosowany jako dodatek w termoplastycznych (takich jak żywice fenolowe), stabilizatory Rayony i PVC w celu poprawy właściwości tworzyw sztucznych. Materiał ten jest używany jako dodatek do ogólnego zastosowania do smarów i tłuszczów.
- Inne zastosowania przemysłowe obejmują produkcję cukru, mydła, saponifikacja tłuszczu, fuzja krzemianów i synteza chemiczna innych związków barowych i związków organicznych.
2. Laboratorium
- Jest stosowany w chemii analitycznej do miareczkowania słabych kwasów, zwłaszcza kwasów organicznych. Gwarantuje, że jego przezroczysty roztwór wodny jest wolny od węglanu, w przeciwieństwie do wodorotlenku sodu i wodorotlenku potasu, ponieważ węglan baru jest nierozpuszczalny w wodzie.
Może ci służyć: Specjalne związki: Charakterystyka, szkolenie, zastosowaniaPozwala to na użycie wskaźników, takich jak fenoloftaleina lub timoftaleina (ze zmianami kolorów alkalicznych) bez ryzyka błędów miareczkowania spowodowanych obecnością jonów węglanowych, które są znacznie mniej podstawowe.
- Jest stosowany czasami w syntezie organicznej jako silna podstawa, na przykład do hydrolizy estrów i nitryle.
- Jest również stosowany w dekarboksylacji aminokwasów, które uwalniają węglan barowy w tym procesie.
- Jest również stosowany w przygotowaniu cyklopentanonu, alkoholu diacetone.
3. Katalizator w reakcji Wittig-horner
Reakcja Wittig-horner, znana również jako Horner-Wadsworth-Emmons (lub reakcja HWE) jest reakcją chemiczną stosowaną w chemii organicznej w celu stabilizacji karbanionów fosfonianowych za pomocą aldehydów (lub ketonów) w celu uzyskania dominujących alqueosów E (trans tranzytu).
Reakcja soncochemiczna Wittig-rorner jest katalizowana przez aktywowany wodorotlenek baru i jest przeprowadzany w warunkach interfejsu stałego cieczowego.
Proces soncoquímico odbywa się w temperaturze pokojowej i z niższym masą katalizatora i czasem reakcji niż proces termiczny. W tych warunkach uzyskuje się plony podobne do procesu termicznego.
Analizowany charakter aktywnego miejsca katalizatora, który działa w procesie. Proces Soncoquímico zaproponuje mechanizm.
4. Inne zastosowania
Wodorotlenek baru ma inne zastosowania, takie jak:
- Produkcja alkalii.
- Szklana konstrukcja.
- Syntetyczna wulkanizacja gumowa.
- Inhibitory korozji.
- Jako płyny wiertnicze, pestycydy i smary.
- Do lekarstwa na kotły.
- Udoskonalić oleje warzywne i zwierzęce.
- Do świeżej farby.
- W wodzie zmiękczaniu.
- Jako składnik środków homeopatycznych.
- Wyczyścić wycieki kwasu.
- Jest również stosowany w branży cukrowej do przygotowywania cukru buraków.
- Materiały budowlane.
- Produkty elektryczne i elektroniczne.
- Powłoki glebowe.
Bibliografia
- Wodorotlenek baru (s.F.). Odzyskany z chemistrylearnera.com.
- Wodorotlenek baru (s.F.). Odzyskane z Chemicalland21.com.
- « Imiona epickie i legendarne (mężczyzna i kobieta)
- Voges-Proskauer Test What Is, Foundation, przygotowanie, używa »

