Aluminiowa struktura wodorotlenku, właściwości, zastosowania, ryzyko
- 958
- 183
- Prokul Woliński
On Wodorotlenek aluminiowy Jest to związek nieorganiczny, którego wzór chemiczny jest w (OH)3. W przeciwieństwie do innych wodorotlenków metali, jest to Amphotero, zdolny do reakcji lub zachowania jak kwas lub podstawa, w zależności od pożywki. Jest to dość nierozpuszczalna biała stała w wodzie, więc uważa go za składnik zobojętniających kwas.
Jak MG (OH)2 lub Brucita, z którym ma pewne cechy chemiczne i fizyczne, wygląda wyłącznie jak amorficzny i świetny; Ale kiedy krystalizuje się z niektórymi zanieczyszczeniami, nabiera postaci krystalicznych, jakby były perłami. Wśród tych minerałów naturalne źródła AL (OH)3, jest Gibbsita.
 Specjalny kryształ Gibbsita. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Specjalny kryształ Gibbsita. Źródło: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Oprócz gibbsite są również minerały Bayerite, Nordstrandite i Doleyíta, tworzące cztery aluminiowe polimorfy wodorotlenkowe. Strukturalnie są one bardzo podobne do siebie, różnicując się nawzajem w sposób, w jaki warstwy lub arkusze jonowe są umieszczone lub sprzężone, a także rodzajem powstrzymanych zanieczyszczeń.
Kontrolując parametry pH i syntezy można przygotować dowolny z tych polimorfów. Podobnie niektóre interesujące gatunki chemiczne mogą być przeplatane między ich warstwami, tak że tworzenie materiałów lub związków przeplatanych. To reprezentuje zastosowanie bardziej technologicznego podejścia do AL (OH)3. Jego inne zastosowania są jak zobojętniacze.
Z drugiej strony jest używany jako surowiec do uzyskania tlenku glinu, a jego nanocząstki zostały użyte jako wsparcie katalityczne.
[TOC]
Struktura
Formuła i Octaedro
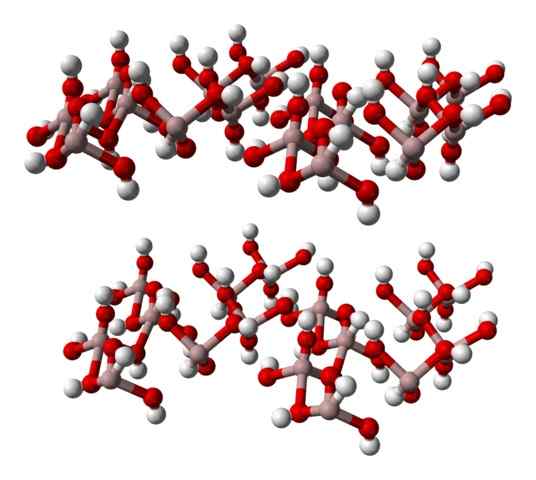
Formuła chemiczna w (OH)3 wskazuje, że związek z3+: Oh- To jest 1: 3; to znaczy, że są trzy aniony oh- dla każdego kationu3+, co jest tym samym, co powiedzenie, że trzecia część jego jonów odpowiada aluminium. AL3+ I och- Oddziałują na elektrostatycznie, dopóki ich atrakcje-powtórzenia nie określają kryształu sześciokątnego.
Jednak Al3+ Niekoniecznie jest otoczony trzema OH- Ale sześć; Dlatego mówi się o koordynacji oktahedron, w (OH)6, w którym jest sześć interakcji al-O. Każda ośmiczeron reprezentuje jednostkę, z którą szklanka jest budowana, a wiele z nich przyjmuje struktury trójklinowe lub monokliniczne.
Niższy obraz częściowo reprezentuje oktahedry do (OH)6, Ponieważ obserwuje się tylko cztery interakcje3+ (jasnobrązowe kule).
 Gibbsite sześciokątne szkło, aluminiowy minerał wodorotlenkowy. Źródło: Benjah-BMM27 [domena publiczna].
Gibbsite sześciokątne szkło, aluminiowy minerał wodorotlenkowy. Źródło: Benjah-BMM27 [domena publiczna]. Jeśli ta struktura jest starannie obserwowana, która odpowiada strukturze minerału gibsite, można zastanowić się, czy białe kule integrują „twarze” lub powierzchnie warstw jonowych; To są atomy wodoru jonów OH-.
Może ci służyć: wynajem halogenurus: właściwości, uzyskiwanie przykładówZauważ, że istnieje warstwa A i kolejna B (przestrzennie nie są identyczne), wraz ze sobą mosty wodorowe.
Polimorfy
Warstwy A i B nie zawsze są sprzężone w ten sam sposób, a także ich fizyczne środowiska lub jony gości (sole) mogą się zmienić. W konsekwencji kryształy Al (OH)3 Różnią się w czterech formach mineralogicznych lub, w tym przypadku, polimorficznym.
Mówi się następnie, że wodorotlenek aluminiowy ma do czterech polimorfów: gibbsite lub hydragilit (monokliniczny), bayerite (monokliniczny), Doyleíta (tricecling) i nordstrandit (trichlinic). Spośród tych polimorfów Gibbsita jest najbardziej stabilna i obfita; Pozostałe są klasyfikowane jako rzadkie minerały.
Gdyby kryształy zaobserwowano na mikroskopie, okaże się, że ich geometria jest sześciokątna (choć nieco nieregularna). PH odgrywa ważną rolę we wzroście takich kryształów i powstałej struktury; to znaczy, biorąc pod uwagę pH polimorf lub inny może tworzyć.
Na przykład, jeśli medium, w którym AL (OH) wytrąca się3 Ma pH mniej niż 5,8 gibbsita; Podczas gdy pH jest większe niż ta wartość, powstaje Bayerita.
W bardziej podstawowych mediach, Nordstrandita i Doyleíta Crystals mają tendencję do tworzenia. Zatem będąc najliczniejszym gibstetem, jest to fakt, że odzwierciedla kwasowość jego środowisk wietrzenia.
Nieruchomości
Wygląd fizyczny
Biała substancja stała, która może być w różnych formatach: granulowany lub proszkowy i wygląd amorficzny.
Masa cząsteczkowa
78.00 g/mol
Gęstość
2,42 g/ml
Temperatura topnienia
300 ° C. Nie ma temperatury wrzenia, ponieważ wodorotlenek traci wodę, aby przekształcić się w tlenk glinu lub tlenku aluminium, do2ALBO3.
Rozpuszczalność wody
1 · 10-4 G/100 ml. Jednak jego rozpuszczalność wzrasta wraz z dodaniem kwasów (h3ALBO+) lub alkalis (och-).
Produkt rozpuszczalności
Ksp = 3 · 10−34
Ta niewielka wartość oznacza, że tylko niewielka część rozpuszcza się w wodzie:
AL (OH)3(sól3+(AC) +3OH-(AC)
I w rzeczywistości ta nikczemna rozpuszczalność sprawia, że jest to dobry neutralizator kwasowości, ponieważ nie opiera zbyt dużej ilości środowiska żołądka, aby nie wydawać prawie jonów oh-.
Anfoteryzm
AL (OH)3 Charakteryzuje się jego postacią amphotera; to znaczy może reagować lub zachowywać się tak, jakby to był kwas lub podstawa.
Na przykład reaguj z jonami H3ALBO+ (Jeśli medium jest wodne), aby utworzyć złożone acuo [do (OH2)6]3+; który z kolei jest hydrolizowany w celu zakwaszenia środowiska, a zatem Al3+ Jon kwasowy:
Może ci służyć: reakcja cannizzaro: cechy, mechanizmy, przykładyAL (OH)3(s) +3H3ALBO+(ac) => [al (OH2)6]3+(AC)
[Al (Och2)6]3+(AC) +H2Lub (l) [al (OH2)5(Oh)]2+(AC)+H3ALBO+(AC)
Kiedy tak się dzieje, mówi się, że Al (OH)3 Zachowuje się jak baza, ponieważ reaguje z h3ALBO+. Z drugiej strony możesz zareagować z OH-, zachowuje się jak kwas:
AL (OH)3(S) +OH-(AC) => AH (OH)4-(AC)
W tej reakcji biały osad Al (OH)3 Rozpuszcza się nad nadmiarem jonów oh-; fakt, że nie dzieje się tak samo z innymi wodorotlenkami, takimi jak magnez, mg (OH)2.
AL (OH)4-, jon glinu, można go wyrażać bardziej odpowiednio jako: [al (OH2)2(OH)4]-, podkreślając liczbę koordynacji 6 dla kationu3+ (Octaedro).
Ten jon może kontynuować reagowanie z większą liczbą- aż do koordynacji oktaedron: [Al (OH)6]3-, nazywany jonem heksahidroxoaluminate.
Nomenklatura
Nazwa „Wodorotlenek aluminiowy”, który najczęściej odnosi się do tego związku, odpowiada rządzonej nomenklatury zapasowej. (III) jest pominięte na końcu, ponieważ status utleniania aluminium wynosi +3 we wszystkich jego związkach.
Pozostałe dwa możliwe nazwiska, które należy odnieść do AL (OH)3 Są to: aluminiowy trihydroksyd, zgodnie z systematyczną nomenklaturą i użyciem liczników greckich; i wodorotlenek aluminiowy, kończący się na sufiks -ico do posiadania jednego stanu utleniania.
Chociaż w polu chemicznym nomenklatura Al (OH)3 Nie reprezentuje żadnego wyzwania ani zamieszania, poza nim zwykle miesza się z niejednoznacznością.
Na przykład minerał Gibbsita jest jednym z naturalnych polimorfów Al (OH)3, do którego nazywają się także γ-al (OH)3 lub α-al (OH)3. Jednak α-al (OH)3 Może również odpowiadać minerałowi Bayerita lub β-al (OH)3, Według nomenklatury krystalograficznej. Tymczasem polimorfy Nordstrandita i Doyleita są zwykle oznaczone po prostu jako (OH)3.
Poniższa lista wyraźnie podsumowuje nowo wyjaśnione:
-Gibbsita: (γ lub α) -al (OH)3
-Bayerita: (α lub β) -al (OH)3
-Nordstrandita: AL (OH)3
-Doyleita: AL (OH)3
Aplikacje
Surowiec
Natychmiastowe zastosowanie wodorotlenku glinu jest surowcem do produkcji tlenku glinu lub innych związków, nieorganicznych lub organicznych, aluminium; Na przykład: ALCL3, Przez nie3)3, Alf3 lub naal (oh)4.
Wsporniki katalityczne
AL (OH) nanocząstki3 Mogą działać jako wsparcie katalityczne; Oznacza to, że katalizator dołącza do nich, aby były przymocowane na ich powierzchni, gdzie reakcje chemiczne są przyspieszane.
Może ci służyć: reakcja syntezy: typy, czynniki, przykładyZwiązki międzynarodowe
W sekcji struktury wyjaśniono, że AL (OH)3 Składa się z warstw lub prześcieradeł A i B, połączone w celu zdefiniowania kryształu. W nim istnieją małe oktaedryczne przestrzenie lub zagłębienia, które mogą być zajęte przez inne jony, metaliczne lub organiczne lub neutralne cząsteczki.
Gdy kryształy są syntetyzowane z (OH)3 Przy tych modyfikacjach strukturalnych mówi się, że przygotowywany jest związek interkalacji; to znaczy przeplatane lub umieszczone gatunki chemiczne między arkuszami A i B. W ten sposób powstają nowe materiały wyprodukowane z tego wodorotlenku.
Ognioodporny
AL (OH)3 Jest to dobry opóźnienie przeciwpożarowe, które uważa zastosowanie jako materiał wypełniający wiele macierzy polimerowych. Dzieje się tak, ponieważ pochłania ciepło do uwalniania pary wodnej, jak to robi MG (OH)2 lub Brucita.
Leczniczy
AL (OH)3 Jest to również neutralizująca kwasowość, reagująca z HCl wydzieliny żołądka; Ponownie, podobnie jak to dzieje się z MG (OH)2 mleka magnezji.
Oba wodorotlenki mogą być mieszane w różnych zobojętniach kwas.
Adsorbent
Gdy jest podgrzewany poniżej temperatury topnienia, wodorotlenek glinu jest przekształcany w tlenek glinu aktywowany (a także węgiel aktywny). Ta substancja stała jest używana jako adsorbent niepożądanych cząsteczek, barwników, zanieczyszczeń lub zanieczyszczających gazów.
Ryzyko
Ryzyko, które może reprezentować wodorotlenek aluminium, nie jest wynikające z tego jako solidne, ale jako lekarstwo. Do przechowywania nie są potrzebne protokoły ani przepisy, ponieważ nie reaguje energicznie z środkami utleniającymi i nie jest też łatwopalne.
Po spożywaniu zobojętniających kwascydy osiągnięte w aptekach, mogą pojawić się niepożądane skutki uboczne, takie jak zaparcia i hamowanie fosforanu jelitowego. Również, i chociaż nie ma badań, aby to wykazać, było to związane z zaburzeniami neurologicznymi, takimi jak choroba Alzheimera.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Aluminium wodorotlenkowe. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2019). Aluminium wodorotlenkowe. Baza danych Pubchem. CID = 10176082. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Danielle Reid. (2019). Aluminium wodorotlenkowe: wzór i skutki uboczne. Badanie. Odzyskane z: Study.com
- Robert Schoen i Charles i. Roberson. (1970). Struktury wodorotlenku glinu i implikacji geochemicznych. The American Mineralogist, vol 55.
- Vitalny p. Isupov & col. (2000). Synteza, struktura, właściwości i zastosowanie związków interkalacji wodorotlenku glinu. Chemia zrównoważonego rozwoju 8121-127.
- Narkotyki. (24 marca 2019 r.). Efekty uboczne wodorotlenku glinu. Odzyskane z: narkotyki.com
- « Historia Vanadio, właściwości, struktura, użycia
- Historia niklu, właściwości, struktura, zastosowania, ryzyko »

