Nienaturowane węglowodory
- 2190
- 545
- Herbert Wróblewski
Wyjaśniamy, jakie nienasycone węglowodory, ich klasyfikacja, nieruchomości, nomenklatura i podajemy kilka przykładów
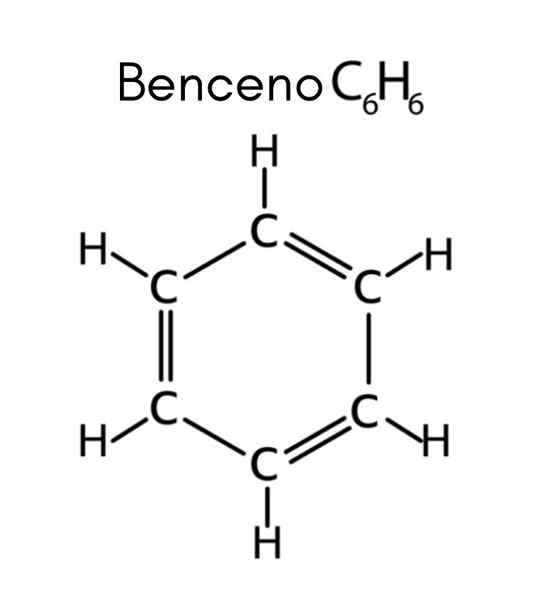
 Benzen jest przykładem nienasyconego węglowodoru
Benzen jest przykładem nienasyconego węglowodoru Jakie są nienasycone węglowodory?
Nienaturowane węglowodory Są to związki organiczne, które powstają tylko przez węgiel i wodór, które mają jeden lub więcej wiązań między atomami węgla. Oznacza to, że dowolna formuła CXHI które stanowią podwójne lub potrójne wiązanie to nienasycony węglowodor.
Nienasycone węglowodory są tworzone przez alkeny i alkiny, a także związki aromatyczne. Powodem, dla którego są nienasyczeni, jest to, że mają mniejszą liczbę hydrogenów niż maksimum, które mogą mieć, biorąc pod uwagę liczbę atomów węgla w strukturze.
Nienasycone węglowodory są rozpoznawane przez posiadanie mniej niż 2n+2 hydrogenów (czyli maksymalna liczba hydrogenów, które mogą być węglem), gdzie n jest liczbą atomów węgla w wzorze molekularnym.
Przykładem nienasyconego węglowodoru jest Buteno, którego wzór molekularny to C4H8. Maksymalna liczba hydrogenów dla 4 węgli byłaby 2 (4) +2 = 10 Hydrogeny. Odpowiada to liczbie hydrogenów nasyconego węglowodoru. Ponieważ Buteno ma tylko 8 hydrogenów, czyli mniej niż 10, wówczas jest to nienasycony węglowodór.
Liczba nienaturacji
Nienasycone węglowodory charakteryzują się liczbą nienasycenia. Wskazuje to, że liczba par wodoru mniej niż nienasycona węglowodór jest porównywana z nasyconą, która ma tę samą liczbę węgli.
Liczbę nienasycenia można obliczyć dla każdego nienasyconego związku za pomocą następującego wzoru:
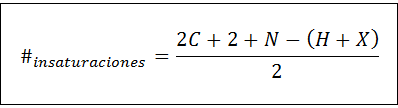
Gdzie C, N, H i X reprezentują odpowiednio liczbę węgli, nitrogenów, hydrogenów i halogenów w wzorze molekularnym. Liczba ta daje nam wyobrażenie o tym, ile podwójnych lub potrójnych wiązań ma związek, biorąc pod uwagę jego wzór molekularny, chociaż należy zachować ostrożność, ponieważ cykle (które nie są nienasyganiami) również przyczyniają się do liczby nienasycenia:

Przykład
Benzen ma formułę C6H6, Tak więc liczba nienaturacji to:
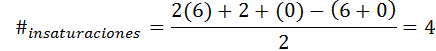
W tym przypadku 4 nienasycenie odpowiada trzem podwójnym łączom i cyklu.
Klasyfikacja nienasyconych węglowodorów
Według rodzaju węglowodorów
- Alkeny: To te, które mają co najmniej jeden podwójny link w swojej strukturze.
- Alkynes: To ci, którzy mają w swojej strukturze co najmniej jeden potrójny link.
- Aromatyczny: Są to cykliczne związki wielonienasycone o specjalnych właściwościach, które czynią je szczególnie stabilnymi.
Według łańcucha węglowego
- Liniowy: Nienaturowane związki, w których wszystkie atomy węgla są ze sobą powiązane w jednym łańcuchu.
- Rozgałęziony: Są to te, które mają główny łańcuch, a także kilka łańcuchów bocznych, które tworzą konsekwencje.
- Cykliczny: Są to te, w których przedstawiono zamknięty cykl atomów węgla, w którym przedstawiono co najmniej jedno wiązanie podwójne lub potrójne (Cycloalquenos, Cycloalquinos i aromatyczne).
Zgodnie z liczbą nienaturacji
- MONOUNSUTATED: Kiedy mają tylko wiele linków, to znaczy jest to pojedyncza podwójna wiązanie lub pojedyncze potrójne link.
- Polynsaturat: Gdy struktura ma więcej niż jedno łącze wielokrotne, jak w przypadku alkijskiego, alkijskiego, alkeniny itp.
Właściwości nienasyconych węglowodorów
Właściwości nienasyconych węglowodorów zależą silnie od konkretnego rodzaju danego węglowodoru:
Punkty fuzji i wrzenia
Ogólnie rzecz biorąc, nienasycone węglowodory mają niskie punkty fuzji i wrzenia. Jednak w porównaniu z alkanami alkenami o tej samej liczbie węgli i podobnego łańcucha głównego zwykle mają niższą temperaturę wrzenia, podczas gdy alkiny mają większe temperatury wrzenia.
To samo dotyczy punktów fuzji. W poniższej tabeli można zauważyć, że zarówno punkt fuzji, jak i gotowanie 1-pentenu są niższe niż Pentan i że te z 1-pentino.

Stan fizyczny
Ze względu na niskie temperatury topnienia i wrzenia, nienasycone węglowodory o niskiej masie cząsteczkowej są zwykle gazowe w temperaturze pokojowej. Wiele z nich jest również ciekłe, a o większej masie cząsteczkowej są stałe. W wielu przypadkach stałe są amorficznymi ciałami stałymi zamiast krystalicznego.
Biegunowość
Wszystkie węglowodory, w tym nienasycone, są związkami apolarnymi, ponieważ elektroonegatywność węgla i wodór są bardzo podobne. Jedynym wyjątkiem jest w przypadku końcowych alkin2 i sp3.
Rozpuszczalność
Będąc niepolarnymi, nienasyconymi węglowodorami są nierozpuszczalne w wodzie i innych rozpuszczalnikach polarnych, ale są bardzo rozpuszczalne w rozpuszczalnikach apolarnych, takich jak tetrachlorku węgla, cykloheksan i inne. W rzeczywistości wiele z tych związków jest same w sobie rozpuszczalniki apolarne.
Może ci służyć: dyspozycja: struktura, właściwości, uzyskiwanie, użyciaSą paliwami
Cechą wszystkich węglowodorów, w tym nienasyconych, jest to, że płoną w obecności tlenu, aby stać się dwutlenkiem węgla i energii uwalniającej wodę w postaci światła i ciepła.
Mogą polimeryzować
Poprzez różne reakcje chemiczne alkeny i alkiny mogą łączyć się ze sobą, tworząc polimery, jak w przypadku polietylenu i polipropylenu, aby wymienić tylko niektóre. Tak nienasycone węglowodory są materiałem początkowym wielu powszechnych tworzyw sztucznych.
Reaktywność chemiczna
Reaktywność zależy silnie od rodzaju grupy funkcjonalnej, która ma cząsteczkę. W przypadku alkenów i alkin są one zwykle dość reaktywne i mogą ponieść reakcje uwodornienia, uwodnienia, hydrohalogenacji i innych rodzajów reakcji dodawania.
Z drugiej strony związki aromatyczne są zwykle dość obojętne, ponieważ są bardzo stabilne. Charakterystyczne reakcje tych związków to aromatyczne elektrofilowe reakcje podstawienia.
Nomenklatura nienasyconych węglowodorów
Nomenklatura alkenów
Liniowe alkeny
Nazwa alkenów liniowych jest zbudowana przez umieszczenie przedrostka, który wskazuje liczbę atomów węgla w łańcuchu, a następnie lokalizator węgla, w którym oddzielne podwójne wiązanie zaczyna się od skryptów od reszty nazwy i wykończona z sufiksem _eno:
Prefiks-lokalizator
- Przykład:
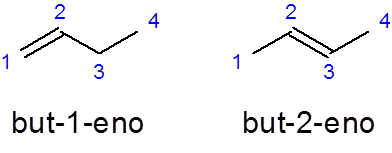
On Ale -1 -NO Jest to nazwa liniowej buteenu z podwójnym wiązaniem w pierwszym węglu, podczas gdy Ale 2-dziewięć Ma podwójne wiązanie w drugim węglu.
Rozgałęzione alkeny
W przypadku rozgałęzionych alken. Nazwa jest zbudowana najpierw przez umieszczenie konsekwencji w kolejności alfabetycznej poprzedzonej jej lokalizatorami, a następnie nazwy głównego łańcucha, jak wskazano powyżej.
- Przykład:
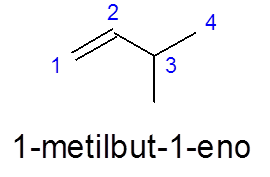
W 3-metylobut-1 -en liczba odbywa się od lewej do prawej, aby nadać priorytet podwójne wiązanie, zamiast nadać priorytet rozgałęzieniu (grupa metylowa).
Polieny
W przypadku alkenów wielonienasyconych lub poliewskich, które zawierają więcej niż jedno podwójne wiązanie, największa możliwa liczba podwójnych wiązań jest wybierana jako łańcuch główny, niezależnie od tego, czy istnieją inne dłuższe łańcuchy.
W nazwie głównego łańcucha dodaje się lokalizator dla każdego podwójnego wiązania i przedrostka di, tri, tetra itp. przed zakończeniem -eno, aby wskazać liczbę podwójnych linków, które masz.
- Przykład:
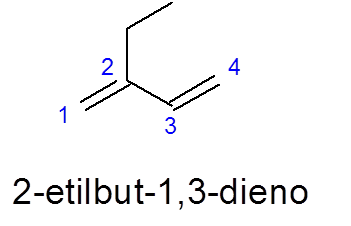
Zwróć uwagę na to, że pomimo faktu, że istnieje dłuższy łańcuch 5 -węglowy, 4 z 4 jest wybierane, ponieważ zawiera dwa podwójne łącza.
Nomenklatura Alquinos
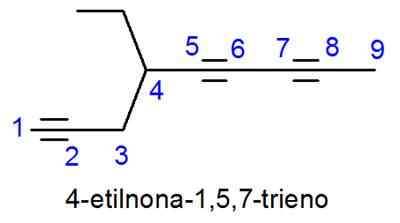
Alkiny nazywane są bardzo podobne do alkenów, z jedyną różnicą, którą nazwa kończy się w -ino zamiast -eno. W przypadkach, w których istnieje więcej niż jeden potrójny ogniwo, lokalizatory wszystkich z nich są umieszczone, a przedrostek numeryczny wskazujący, ile jest.
- Przykład:
Nomenklatura związków aromatycznych
Aromatyczne węglowodory są mianowane jako pochodne benzen.
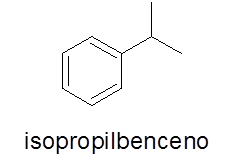
Pierścienie aromatyczne z pojedynczym podstawem
W takim przypadku nie jest to konieczne. Nazwa składa się z nazwy gałęzi, a następnie słowa benzen.
- Przykład:
Pierścienie aromatyczne z dwoma podstawnikami
W takim przypadku można podać 3 liczby lub wzorce zastępcze (1.2), (1.3) i (1,4). Ponieważ jest obojętne, aby wskazać, który substytut jest w węglu 1, a który w drugim, orto prefiks (o-), meta.
- Przykłady:
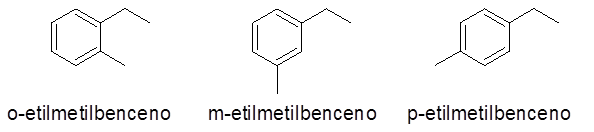
Pierścienie aromatyczne z więcej niż 2 podstawnikami
W takim przypadku wybierana jest liczba najmniejszej kombinacji lokalizatorów. Jeśli dwie liczby są równe, priorytet podaje się podstawnikom zgodnie z kolejnością alfabetyczną.
- Przykłady:
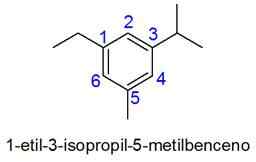
Przykłady nienasyconych węglowodorów
Następnie przedstawiono dodatkowe przykłady nienasyconych węglowodorów.
Acetylen (c2H2)
Acetylen jest popularną nazwą Etino, najprostszej alcheminy. Ten związek ma 2 nienasycenie ze względu na potrójne połączenie i jest używany między innymi w sprzęcie stalowym i spawalniczym.
Cyclohexen (c6H10)
6 -węglowy cykliczny alken, który ma dwie nienasycenie: jeden z powodu cyklu, a drugi z powodu podwójnego wiązania.
Rozciągnij (c8H8)
Ten związek jest powszechnie stosowany w przygotowaniu polimerów. Jest to aromatyczny alken z 5 nienasyceniem.

