Hydroliza to, co polega na i przykładach reakcji
- 4967
- 734
- Bertrand Zawadzki
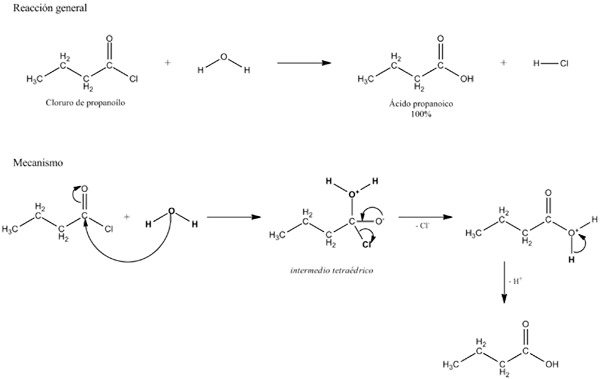
hydroliza Jest to reakcja chemiczna, która może wystąpić zarówno w cząsteczkach nieorganicznych, jak i organicznych lub jonach, i która obejmuje udział wody w rozbiciu jej wiązań. Jego imię pochodzi od greckiego, „hydro” wody i „lizy” pęknięcia.
Cząsteczka wody, H2Lub ustanawia równowagę z jonami soli kwasowych i słabych zasad, pojawiając się po raz pierwszy koncepcja ogólnych badań chemii i chemii analitycznej. Jest to zatem jedna z najprostszych reakcji chemicznych.
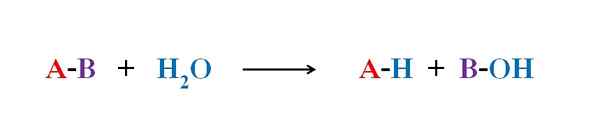 Ogólne równanie reakcji hydrolizy. Źródło: Gabriel Bolívar.
Ogólne równanie reakcji hydrolizy. Źródło: Gabriel Bolívar. W kilku przykładach hydrolizy sama woda nie jest w stanie złamać pewnego kowalencyjnego wiązania. Gdy tak się dzieje, proces przyspiesza lub katalizuje zakwaszenie lub alkalizację pożywki; to znaczy w obecności jonów H3ALBO+ lub och-, odpowiednio. Istnieją również enzymy, które katalizują hydrolizę.
Hydroliza zajmuje szczególne miejsce pod względem biomolekuł, ponieważ powiązania, które utrzymują ich monomery razem, są podatne na hydrolizator w określonych warunkach. Na przykład cukry są hydrolizowane w celu rozkładu polisacharydów w swoich składowych monosacharydach dzięki działaniu enzymów glukozydazy.
[TOC]
Co to jest hydroliza?
Górny obraz wyjaśnia, z czego składa się hydroliza. Zauważ, że nie tylko cząsteczka lub podłoże (jeśli pośredniczą w enzymach) łamie ich związek, ale także samą wodę, czyli „złamanie” w H H+ I och-, Gdzie h+ kończy się a a- z B. A-B reaguje z cząsteczką wody pochodzącą z dwóch produktów, A-H i B-OH.
Hydroliza jest zatem reakcją sprzeczną z kondensacją. W kondensacji dwa produkty, jak powiedzieć A-H i B-OH, są wiążące przez uwalnianie małej cząsteczki: woda. W hydrolizy spożywana jest cząsteczka, podczas gdy w kondensacji jest uwalniana lub wytwarzana.
Może ci służyć: grupa karbonylowa: charakterystyka, właściwości, nomenklatura, reaktywnośćWracając do przykładu cukrów, załóżmy, że A-B odpowiada dimerowi sacharozy, w którym reprezentuje glukozę, a fruktozę B. A-B, łącze glukozydowe może hydrolizaryzować, aby powstać dwa monosacharydy osobno i w roztworze, a to samo dzieje się z oligo i polisacharydami, jeśli pośredniczą w enzymach w takich reakcjach.
Zauważ, że w tej reakcji A-B strzałka ma tylko jeden adres; to znaczy jest nieodwracalną hydrolizę. Jednak wiele hydrolizy to w rzeczywistości odwracalne reakcje, które osiągają równowagę.
Przykłady reakcji hydrolizy
- ATP
ATP jest stabilny między wartościami pH 6,8 i 7,4. Jednak przy ekstremalnych wartościach pH jest spontanicznie hydrolizowany. W żywych istotach hydroliza jest katalizowana przez enzymy znane jako Atasas:
ATP +H2O => ADP +PI
Ta reakcja jest silnie egzergoniczna, ponieważ entropia ADP jest większa niż ATP. Gibbs Wariacja energii swobodnej (GGº) wynosi - 30,5 kJ/mol. Energia wytwarzana przez hydrolizę ATP jest stosowana w licznych reakcjach endergonowych.
Sprzężone reakcje
W niektórych przypadkach hydroliza ATP stosuje się do konwersji związku w związku (B).
A +ATP +H2Lub B +ADP +PI +H+
- Woda
Dwie cząsteczki wody mogą reagować na siebie w pozornej hydrolizy:
H2Lub + h2Lub h3ALBO+ + Oh-
To tak, jakby jedna z tych cząsteczek wody złamana w h+ I och-, Zamierzam połączyć H+ Do atomu tlenu innej cząsteczki wody, która powoduje jon hydrium, h3ALBO+. Ta reakcja, bardziej niż hydroliza, dotyczy samorozrokolizy wody.
Może ci służyć: Energia aktywacji- Białka
Białka są stabilnymi makrocząsteczkami i aby osiągnąć całkowitą hydrolizę, w aminokwasach, które je stanowią, wymagane są ekstremalne warunki; takie jak stężenie kwasu solnego (6 m) i wysokie temperatury.
Jednak żywe istoty są obdarzone enzymatycznym arsenałem, który umożliwia hydrolizę białek w aminokwasach w dwunastnicy. Enzymy zaangażowane w trawienie białka są prawie całkowicie wydzielane przez trzustkę.
Istnieją enzymy egzopeptydazy, które degradują białka, zaczynając od ich końca: aminopeptydaza przez koniec aminowy i karboksypeptydaza przez koniec karboksyl. Enzymy endopeptydazy wywierają swoje działanie wewnątrz łańcucha białkowego, na przykład: Tripsin, pepsyna, chimotrypsyna itp.
- Amidas i estry
Amidy po podgrzaniu w alkalicznym pożywce pochodzą kwas karboksylowy i aminę:
Rconh2 + H2O => rcoo- + NH2
Ostra w wodnej pożywce są hydrolizowane w kwasie karboksylowym i alkoholu. Proces jest katalizowany przez zasadę lub kwas:
RCO-lub ' +H2O => rcooh +r'oh
To jest słynna reakcja saponizacji.
- Baza kwasowa
W wodzie kilka gatunków jest hydrolizowanych w celu zakwaszenia lub alkalizacji środowiska wodnego.
Dodanie podstawowej soli
Octan sodu, podstawowa sól, dysocjuje w wodzie, dając jony NA+ (sód) i cho3Gruchać- (octan). Jego zasadowość wynika z tego, że octan jest hydrolizowany w celu generowania jonów OH-, podczas gdy sód pozostaje niezmieniony:
Ch3Gruchać- + H2Lub Ch3Cooh +Oh-
Może ci serwować: salicylan metyluOH- Jest odpowiedzialny za zwiększenie pH i stać się podstawowym.
Dodanie soli kwasowej
Chlorek amonu (NH4Cl) powstaje przez jon chlorkowy (Cl-) z kwasu chlorowodorowego (HCL), silnego kwasu i kationu amonu (NH4+) z wodorotlenku amonu (NH4Och), słaba baza. Cl- Nie dysocjuje w wodzie, ale kation amonu jest przekształcany w wodę w następujący sposób:
NH4+ + H2Lub NH3 + H3ALBO+
Hydroliza kationu amonu wytwarza protony, które zwiększają kwasowość wodnej pożywki, więc stwierdza się, że NH4CL jest solą kwasową.
Dodanie neutralnej soli
Chlorek sodu (NaCl) jest produktem solnym reakcji silnej zasady (NaOH) z silnym kwasem (HCL). Podczas rozpuszczenia chlorku sodu w wodzie wytwarzany jest kation sodu+) i anion (cl-). Oba jony nie dysocjują w wodzie, więc nie dodają h+ lub och-, Utrzymanie stałego pH.
Dlatego mówi się, że chlorek sodu jest solą neutralną.
Bibliografia
- Mathews, c. K., Van Holde, K. I. I ahern, k. G. (2002). Biochemia. (Trzecia edycja). Edytować. Pearson-Addison Wesley.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Helmestine, Anne Marie, pH.D. (13 stycznia 2019). Hydroliza: definicja i przykład. Odzyskane z: Thoughtco.com
- Theresa Phillips. (28 kwietnia 2019). Wyjaśnienie procesu hydrolizy. Odzyskane z: balita.com
- Redaktorzy Enyclopaedia Britannica. (16 listopada 2016). Hydroliza. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Wikipedia. (2019). Hydroliza. Źródło: w:.Wikipedia.org
- « Charakterystyka Hyracotherium, odżywianie, gatunki, reprodukcja
- HISTORIA ORGINS Gry wideo do wirtualnej rzeczywistości »

