Struktura hydrazyny, właściwości, synteza,

- 3230
- 665
- Arkady Sawicki
Hydrazyna Jest to związek nieorganiczny, którego wzór chemiczny wynosi n2H4. Składa się z członka rodziny hydrorów azotowych, a najprostsze jest najprostsze ze wszystkich istot. Chociaż jego cząsteczka wydaje się prostotą, wykazuje kilka właściwości chemicznych i fizycznych, które sprawiają, że hydrazyna jest interesującą i energetycznie obiecującą substancją.
Zachowaj bliskie podobieństwo z wodą, ponieważ oba istnieją jako substancje ciekłe w podobnych odstępach czasu. Od hydrazyny możemy uzyskać pochodne organiczne, zastępując jego hydrogeny grupami gazetowanymi. Ponadto z syntetyzowanych hydrazonów, hydrazydów i soli hydrazyny.
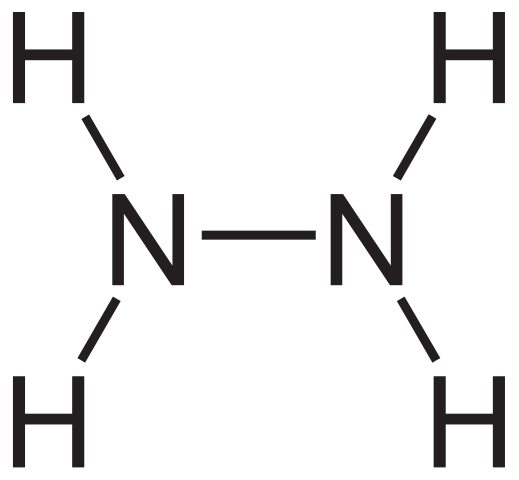 Hydrazyna formuła strukturalna. Źródło: Neuropoger przez Wikipedia.
Hydrazyna formuła strukturalna. Źródło: Neuropoger przez Wikipedia. Strukturalną formułę hydrazyny można zobaczyć powyżej, co można zapisać jako h2Nnh2 lub h2N-NH2. Jeśli spojrzysz uważnie, wydaje się, że dwie cząsteczki NH3 Połączyliby ze sobą. Jednak w tworzeniu łącza N-N nie tylko cząsteczki amoniaku, gdy zaangażowane są odczynniki.
Hydrazyna to związek, który ma wiele zastosowań, ponieważ jest doskonałym prekursorem dla symfin związków, zarówno organicznych, jak i nieorganicznych. Podobnie, dzięki jego mocy zmniejszającej i produktom rozkładu, ma na celu wyeliminowanie tlenu i innych gazów, pozyskiwanie metali szlachetnych; A zwłaszcza, aby zwiększyć statek kosmiczny i stwierdzić -f -arart samolot.
[TOC]
Struktura hydraciny
Cząsteczka i link
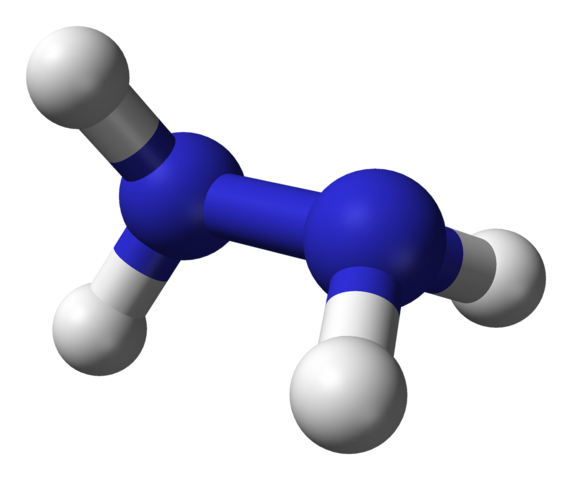 Struktura molekularna hydrazyny. Źródło: Ben Mills przez Wikipedia.
Struktura molekularna hydrazyny. Źródło: Ben Mills przez Wikipedia. Na górnym obrazie mamy cząsteczkę hydrazyny reprezentowaną przez modelki i pręty. Należy zauważyć, że przestrzenna orientacja atomów wodoru, białych kul, kontrastuje z wrażeniem oferowanym przez formułę strukturalną; to znaczy hydrogeny obu -Nh2 Nie są wyrównane ani przyćmione, ale mają ze sobą kąt obrotu 95º.
W rzeczywistości jest tak bardzo, że łącze N-N jest ledwo w stanie obrócić się, mając barierę energetyczną, którą należy wygasnąć, aby zaćmienie cztery atomy wodoru.
O czym to jest? Zasadniczo, do silnych odpychania elektronicznego, które wzajemnie doświadczają dwóch par samotnych elektronów na atomach azotu. Ten kąt 95º jest tym, który nadaje cząsteczce hydrazyny największą stabilność.
Może ci służyć: bromek litowy: struktura, właściwości, zastosowania, ryzykoGeometrie
Każdy atom azotu ma hybrydyzację SP3, przyjęcie trójkątnej geometrii piramidy. Dlatego w przypadku pary wolnych elektronów cząsteczka hydraciny, taka jak dwie piramidy połączone jednym z jej wierzchołków, można wizualizować, a w których centrach atomy azotu będą zlokalizowane.
Interakcje międzycząsteczkowe
Formuła H2Nnh2 Mógłbym podać fałszywy pomysł, że hydrazyna jest związkiem niepolarnym do połączenia dwóch równych grup. Jednak struktura molekularna i jej obrócone wiązanie N-N pokazują, że cząsteczka nie jest całkowicie symetryczna, wspominając również, że ich wolne pary elektronów nie wskazują w przeciwnych kierunkach.
Oznacza to, że hydrazyna, będąc strukturalnie i elektronicznie asymetrycznym, przedstawia moment dipolowy. I dlatego ich cząsteczki oddziałują ze sobą przez dipol-dipol2Nnh2-NH2NH2, które są odpowiedzialne za hydrazynę o bardzo wysokiej temperaturze wrzenia.
Właściwości hydraciny
 Hydrazyna hydrat. Źródło: LHCHEM/CC BY-SA (https: // CreativeCommons.Org/licencje/by-sa/3.0)
Hydrazyna hydrat. Źródło: LHCHEM/CC BY-SA (https: // CreativeCommons.Org/licencje/by-sa/3.0) Wygląd fizyczny
Hydrazyna to bezbarwna ciecz podobna do wody w odniesieniu do lepkości i gęstości. Po oparzeniu emituje białe opary, oprócz zdobywania amoniaku i ryb.
Masa cząsteczkowa
32.0452 g/mol
Temperatura topnienia
2 ° C.
Punkt wrzenia
114 ° C. Należy zauważyć, że hydrazyna istnieje w stanie ciekłym w przedziale temperatury 2-114 ° C, bardzo podobny do wody, 0-100 ° C.
Gęstość
1.021 g/cm3
Gęstość pary
1.1 w związku powietrza.
Ciśnienie pary
Około 0.010 atm o 30.7 ° C
Rozpuszczalność
Hydrazyna jest mieszana z wodą, a także z kilkoma podstawowymi alkohoami. Hydrazyna tworzy hydrat z wodą, n2H4· H2Lub, który charakteryzuje się byciem gęstszym niż czystą lub bezwodną hydrazyną. Ten hydrat jest najczęściej sprzedawanym produktem, ponieważ jest bardziej stabilny i tani.
Moment dipolarny
1.85 d. Jest to raczej substancja polarna, prawie taka sama jak woda.
Może ci służyć: kwas jodłowy (Hio3): struktura, właściwości, ryzyko i zastosowaniaBreja
0.876 CP
Punkt flash
52 ° C
Temperatura samo -kierunkowego
Różni się w zależności od substancji lub powierzchni, z którymi się kontaktuje. Na przykład na tlenkach żelaza spala się w 23 ° C, podczas gdy na szkło lub innych pojemnikach nie zaczyna się zapalić do 270 ° C.
Rozkład
Kiedy pali się w powietrzu, rozkłada się w tlenkach azotu, nieX. Ale w odniesieniu do jego katalitycznego rozkładu, to znaczy, że uzyskuje się produkty, takie jak amoniak, azot i wodór oraz ogromna ilość ciepła, które kończą się płonącego, ale niewidocznego płomienia.
Reaktywność
Hydrazyna jest dobrym środkiem redukującym, ponieważ po utlenionym wytwarzaniu wody i azotu oba związki, które nie cierpią.
Z drugiej strony hydrazyna jest nukleofilem, ponieważ wykorzystuje swoje wolne pary elektronów do łączenia innych cząsteczek organicznych. Podobnie może cierpieć zastąpienie3, Aby wytworzyć metylowane pochodne: CH3NHNH2 lub (rozdz3)2Nnh2.
Reaguje z silnymi kwasami, tworząc sole Hidrazinio, n2H5X, a z Hidrazonio, n2H6X2. Te ostatnie są najmniej powszechne. Siarczan hydrazyniowy, [n2H5] HSO4, Przygotowuje się go przez reakcję hydratu hydrazynowego kwasem siarkowym.
Zasadowość
Hydrazyna jest słabszą podstawą niż amoniak:
N2H4(AC) + H2Lub (l) ⇌ n2H5+(AC) + OH-(AC)
KB = 1.3 · 10-6
Wynika to z faktu, że kwas koniugatu hydrazinio2H5+ lub h3N+-NH2, ma obciążenie destabilizowane przez efekt atraktorowy grupy NH2; to znaczy, zamiast zapewniać gęstość elektroniczną dodatnim azotem, wycofanie.
Hydrazyna jest w stanie cierpieć drugą, znacznie mniej prawdopodobną protonacją, która generuje jeszcze bardziej niestabilny sprzężony kwas:
N2H5+(AC) + H2Lub (l) ⇌ n2H6+(AC) + OH-(AC)
KB = 8.4 · 10-16
Hydrazon, n2H6+ lub h3N+-N+H3, Jest bardzo niestabilny ze względu na odpychanie między dodatnimi obciążeniami obu atomów azotu. Jednak w towarzystwie niektórych anionów może istnieć jako sól.
Toksyczność
Hydrazyna anhydra jest wyjątkowo toksyczną, żrącą i prawdopodobnie rakotwórczą substancją, nie wspominając o tym, że jest bardzo wybuchowa, więc należy ją manipulować jedynie w ramach ścisłych protokołów bezpieczeństwa.
Może ci służyć: współczynnik ściśliwości: jak obliczyć, przykłady i ćwiczeniaSynteza
Najczęściej stosowaną metodą syntezy hydrazyny jest proces Raschig. Składa się z następujących dwóch reakcji:
NH3(AC) + NaOCl (AC) → NH2Cl (AC) + NaOH (AC)
2nh3(AC) + NH2CL (AC) → N2H4(AC) + NH4CL (AC)
Ostatecznie powstaje hydrat n2H4· H2Lub, który jest destylowany w obecności KOH lub NaOH jako suchych ciał stałych:
N2H4· H2O → n2H4
W ten sposób uzyskiwana jest hydrazyna bezwodności i powstaje link N-N.
Zastosowanie hydrazyny
 Hydrazyna jest jedną z najbardziej docenianych substancji w boomie lotniczym. Źródło: Pxhere.
Hydrazyna jest jedną z najbardziej docenianych substancji w boomie lotniczym. Źródło: Pxhere. - Hydrazyna, w obecności metalowych katalizatorów, jest egzotermicznie rozkładana w celu wytworzenia azotu i wodoru, zapewniając w ten sposób wystarczającą energię do zwiększania samolotów, rakiet i satelitów.
- Ta tendencja do rozkładania i powodowania gazów jest dokładnie stosowana do nadmuchania materiałów polimerowych, takich jak guma lub polietylen, zamieniając je w odpowiednie piany.
- Podobnie, uwalniając gazów, mogą one przeciągać inne, które są rozpuszczane w rurach z rur, więc bardzo przydatne jest wyeliminowanie tlenu z kotłów, unikając w ten sposób, aby je korodować.
- Hydrazyna jest materiałem prekursorowym dla wielu związków organicznych o funkcjach farmakologicznych, przeciwgielinie, herbicydach, owadobójczych, nawozach itp. Wynika to z tego, że syntetyzuje się szeroką gamę cyklicznych pochodnych azotowych.
- Wreszcie, będąc dobrym środkiem redukującym, hydrazyna i jej sole hydrazinium są wykorzystywane do zmniejszenia minerałów metali szlachetnych, mają ogromną wartość w przemyśle metalurgicznym.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Hydrazyna. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2020). Hydrazyna. Podsumowanie Pubchem Comunund dla CID 9321. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Redaktorzy Enyclopaedia Britannica. (2020). Hydrazyna. Britannica Encyclopaedia. Odzyskane z: Britannica.com
- Iridium Następnie. (20 czerwca 2017 r.). Hydrazyna - toksyczna dla ludzi, ale satelity to uwielbiają. Odzyskane z: iridium.com

