Hybrydyzacja chemiczna
- 698
- 41
- Eliasz Dubiel
Co to jest hybrydyzacja chemiczna?
Hybrydyzacja chemiczna Jest to „mieszanka” orbitali atomowych, której koncepcja została wprowadzona przez chemika Linusa Paulinga w 1931 r. W celu pokrycia niedoskonałości teorii linków Walencji (TEV). Które niedoskonałości? Są to: geometria molekularna i równoważne powiązania w cząsteczkach, takich jak metan (CH4).
Według TEV, w metanie orbitale atomowe C tworzą cztery powiązania σ z czterema atomami H. Orbitale 2p, z formami ∞ (niższy obraz) C są do siebie prostopadłe, więc H należy usunąć ze siebie pod kątem 90º.

Dodatkowo 2s (sferyczny) orbital. Jednak eksperymentalnie stwierdzono, że kąty w CH4 Wynoszą 109,5º, a ponadto długości linków C-H są równoważne.
Aby to wyjaśnić, należy uznać kombinację oryginalnych orbitali atomowych, tworząc cztery zdegenerowane orbitale hybrydowe (o równej energii). Tutaj wchodzi hybrydyzacja chemiczna. Jak tam hybrydowe orbitale? To zależy od orbitali atomowych, które je generują. Wykazują również mieszankę ich charakterystyk elektronicznych.
Sp3
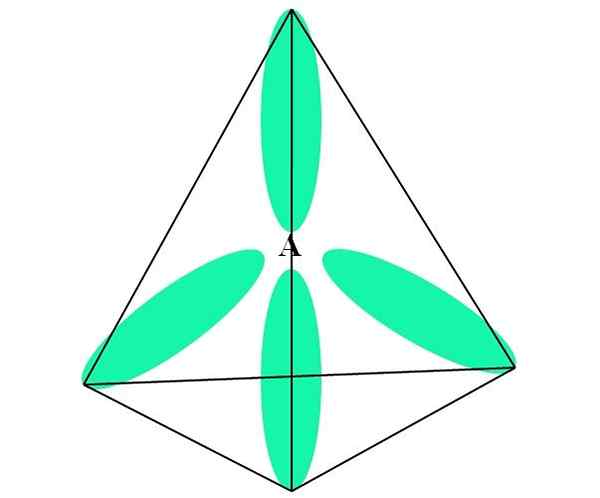
W przypadku CH4, C hybrydyzacja to sps3. Z tego podejścia geometria molekularna wyjaśniono czterema orbitalami SP3 oddzielone na 109,5º i skierowane w stronę wierzchołków czworościanu.
Na górnym obrazie możesz zobaczyć, w jaki sposób orbitale sp3 (Zielony) Ustanowienie czworościennego środowiska elektronicznego wokół atomu (A, które jest C dla CH4).
Może ci służyć: aminyDlaczego 109,5º, a nie inne kąty, aby „narysować” inną geometrię? Przyczyną jest fakt, że kąt ten minimalizuje elektroniczne odpychanie czterech atomów, które są powiązane.
W ten sposób cząsteczka Cho4 Może być reprezentowany jako czworościan (czworościenna geometria molekularna).
Gdyby zamiast H, C utworzył powiązania z innymi grupami atomów, to, co by to byłoby hybrydyzacja? Pod warunkiem, że węgiel tworzy cztery łącza σ (C-A), jego hybrydyzacja będzie sprzenana3.
Można konsekwentnie zakładać, że w innych związkach organicznych, takich jak CH3Och, CCl4, C (rozdz3)4, C6H12 (cykloheksan) itp., Węgiel ma hybrydyzację SP3.
Jest to niezbędne do szkicowania struktur organicznych, w których węgle z prostymi linkami reprezentują punkty rozbieżności; Oznacza to, że struktura nie pozostaje w jednej płaszczyźnie.
Interpretacja
Jaka jest najprostsza interpretacja tych hybrydowych orbitali bez rozwiązania aspektów matematycznych (funkcje fali)? Orbitale sp3 Sugerują, że powstały cztery orbitale: jeden s i trzy p.
Ponieważ połączenie tych orbitali atomowych ma być idealne, cztery orbitale SP3 wynikowe są identyczne i zajmują różne orientacje w przestrzeni (na przykład w orbitalach pX, PI I pz).
Powyższe ma zastosowanie do reszty możliwych hybrydyzacji: liczba utworzonych orbitali hybrydowych jest taka sama jak w łączeniu orbitali atomowych. Na przykład SP Híbridos Orbital3D2 Powstają z sześciu orbitali atomowych: jeden s, trzy p i dwa.
Odchylenia od kątów łącza
Zgodnie z teorią odpychania par elektronicznych warstwy Valencia (RPECV) para wolnych elektronów zajmuje większą objętość niż połączony atom. Powoduje to odejście linków, zmniejszając napięcie elektroniczne i rozkładając kąty 109,5º:
Może ci służyć: rejs po tygle: cechy, funkcje, użyj przykładów
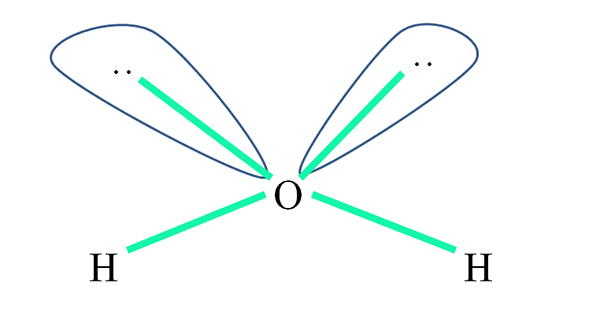
Na przykład w cząsteczce wody atomy H są powiązane z orbitaliami sp3 (w kolorze zielonym), a także pary elektronów, które nie są udostępnione ”:„ Zajmij te orbitale.
Odpulsje tych par elektronów są zwykle reprezentowane jako „dwa balony o oczach”, które ze względu na ich objętość odpychają dwa łącza σ O-H.
Zatem w wodzie kąty ogniw są naprawdę 105º, zamiast 109,5º oczekiwanych dla geometrii czworościennej.
Jaka geometria ma wtedy H2ALBO? Ma geometrię kątową. Ponieważ? Ponieważ podczas gdy geometria elektroniczna jest czworościenna, dwie pary nie udostępnionych elektronów zniekształcają ją do geometrii molekularnej kątowej.
Sp2
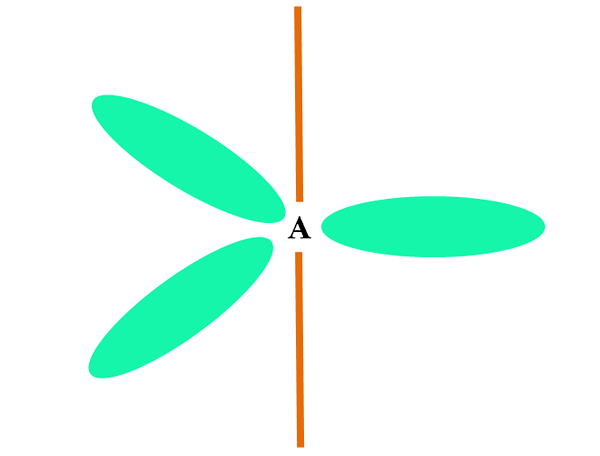
Gdy atom łączy dwa lub s orbitale, generuje trzy hybrydowe orbitale SP2; Jednak orbital P (ponieważ są trzy) pozostaje niezmieniony, który jest reprezentowany jako pomarańczowy pręt na górnym obrazie.
Tutaj trzy orbitale sp SP2 Są zielone, aby podkreślić swoją różnicę w stosunku do pomarańczowego paska: Orbital P „czysty”.
Atom z hybrydyzacją SP2 Można go wizualizować jako trygonalną płaską podłogę (trójkąt narysowany z orbitali SP2 zielony), z wierzchołkami oddzielonymi kątami 120º i prostopadłymi do baru.
I jaką rolę odtwarza Orbital Pure Pure? Aby utworzyć podwójne wiązanie (=). Orbitale sp2 Umożliwiają tworzenie trzech linków σ, podczas gdy orbitalne czyste wiązanie p π (podwójne lub potrójne łącze obejmuje jedno lub dwa łącza π).
Na przykład, aby narysować grupę karbonylową i strukturę cząsteczki formaldehydu (H (H2C = o), kontynuuje następująco:
Może ci służyć: cykopropan (C3H6)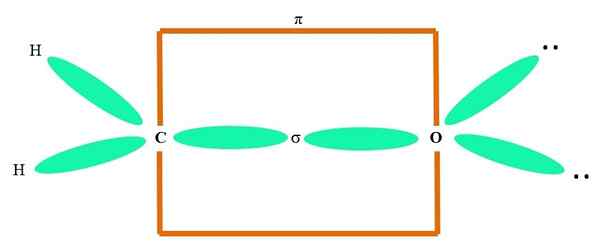
Orbitale sp2 Zarówno C, jak i O tworzą łącze σ, podczas gdy jego czyste orbitale tworzą wiązanie π (prostokąt pomarańczowy).
Można zauważyć, w jaki sposób reszta grup elektronicznych (atomy H i pary nie wspólnych elektronów) znajdują się w innych orbitalach SP2, oddzielone 120º.
Sp
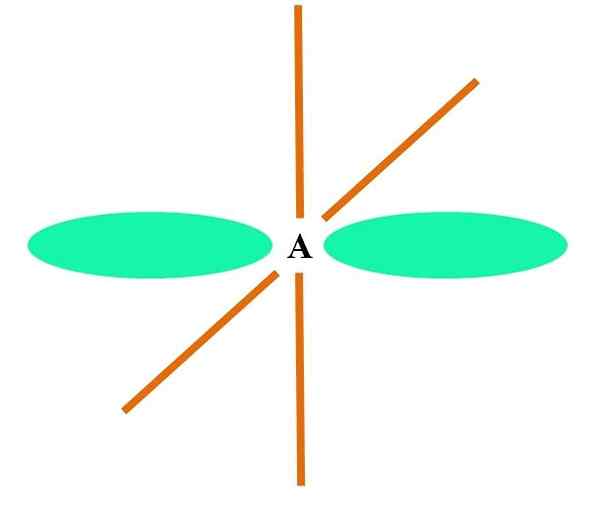
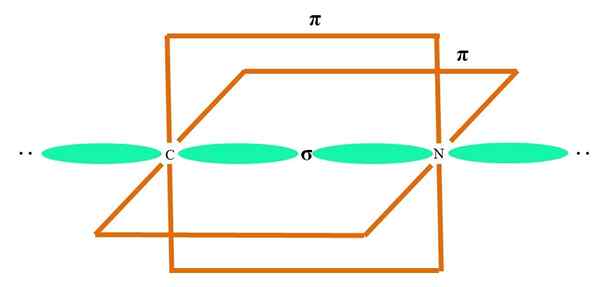
Na obrazie wyższym atomem ilustruje hybrydyzacja SP. Tutaj, orbital i orbital p. Jednak teraz nie zmieniono dwóch czystych orbitalnych orbitali, które pozwalają im utworzyć dwa podwójne łącza lub potrójne łącze (≡).
Innymi słowy: jeśli w strukturze A C jest zgodne z powyższym (= C = O C≡C), wówczas jego hybrydyzacja jest sp. W przypadku innych mniej ilustracyjnych atomów - takich jak metale przejściowe - opis geometrii elektronicznych i molekularnych jest skomplikowany, ponieważ orbitale d, a nawet F są również rozważane.
Hybrydowe orbitale są oddzielone pod kątem 180º. Z tego powodu połączone atomy są ułożone w liniowej geometrii molekularnej (B-A-B). Wreszcie, na dolnym obrazie widać strukturę anionów cyjanku: