Struktury heksochinazowe, funkcje, formy
- 2996
- 572
- Pani Gilbert Stolarczyk
Heksochinaza (HK) to enzym, który katalizuje pierwszą reakcję trasy glikolitycznej praktycznie we wszystkich żywych organizmach, zarówno u prokariotów, jak i w eukariotach. Odpowiada za przeniesienie grupy fosforylowej na glukozę, wytwarzając glukozę-6p, chociaż może również fosforyzować inne cukry sześciokątne (6 atomów węgla).
Ten enzym jest klasyfikowany w jednej z dwóch rodzin enzymów glukozy -kinazy (enzymy, które przenoszą grupy fosforylowe do substratów, takich jak glukoza): rodzina heksochinazy (HK), której członkowie są podzielone na trzy różne grupy znane jako grupa HK, The HK, The HK, Grupa A i grupa B.
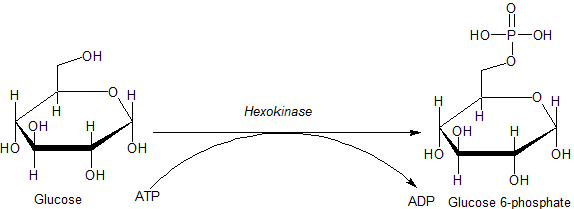
 Reakcja katalizowana przez enzym heksochinazy (źródło: JMUN7616 [domena publiczna] przez Wikimedia Commons)
Reakcja katalizowana przez enzym heksochinazy (źródło: JMUN7616 [domena publiczna] przez Wikimedia Commons) Enzymy należące do rodziny HK charakteryzują się fosforylacją glukozy na koszt ATP jako cząsteczki donatora grupy fosforylowej, a elementy tego samego różnią się głównie w odniesieniu do ich masy cząsteczkowej i specyficzności substratu.
Grupa HK należy do enzymów organizmów eukariotycznych (ATP: D-heksose 6-fosfotransferazy), tymczasem grupa A jest reprezentowana przez enzymy bakterii gram-ujemnych, cyjanobakterie, amitokondynie i protistów tripanosomatydowych, a grupa B zawiera enzymy gramatyczne -Pozytywne bakterie i organizmy Creanarqueotas.
Enzymy grup A i B są również znane jako glikoquinazy (GLCK), ponieważ są zdolne do wyłącznie fosforylacji glukozy, dlatego enzymy te są nazywane ATP: D-glukozę 6-fosfotransferazą.
Jako enzym glikolityczny, heksochinaza ma ogromne znaczenie metaboliczne, ponieważ bez niej ta ważna droga nie byłaby możliwa, a komórki wysoce zależne od zużycia węglowodanów, takich jak na przykład komórki mózgu i mięśni wielu ssaków, miałyby poważne impedymenty funkcjonalne i fizjologiczne ogólnie.
[TOC]
Struktura
Jak widać później, u ssaków i innych kręgowców (a także w organizmach jednokomórkowych, takich jak drożdże) istnieją różne rodzaje enzymów heksochinazowych. U ssaków opisano cztery: izoform I, II, III i IV.
Może ci służyć: stopy żelaza: cechy, typy, przykładyPierwsze trzy izoenzymy mają masę cząsteczkową 100 kDa, ale izoenzym IV ma 50 kDa. Te izoenzymy (szczególnie I-III) wykazują wysokie podobieństwo sekwencji między nimi w odniesieniu do ich końców C i N-końcowych, a także innych członków rodziny heksochinazy.
N-końcowa domena tych enzymów jest uważana za domenę „regulatora”, podczas gdy aktywność katalityczna jest przeprowadzana przez domenę C-końcową (HK II ssaków ma aktywne miejsca w obu domenach).
Domena N-końcowa jest powiązana z domeną C-końcową przez śmigło alfa, każda z nich ma około 50 kDa masę cząsteczkową i ma połączenie glukozy.
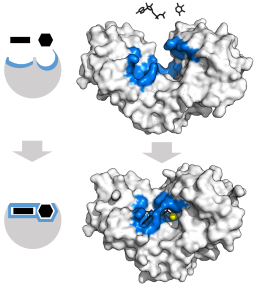 Indukowany model dostosowania enzymu heksochinazy (w odniesieniu do dwóch podłożów: ATP i glukozy) (źródło: Thomas Shafee [CC o 4.0 (https: // creativeCommons.Org/licencje/według/4.0)] przez Wikimedia Commons)
Indukowany model dostosowania enzymu heksochinazy (w odniesieniu do dwóch podłożów: ATP i glukozy) (źródło: Thomas Shafee [CC o 4.0 (https: // creativeCommons.Org/licencje/według/4.0)] przez Wikimedia Commons) Struktura trzeciorzędowa tych enzymów składa się zasadniczo z arkuszy rozmieszczonych β zmieszanych z śmigieł alfa, których odsetek zmienia się w odniesieniu do enzymu i danego gatunku; Miejsce Unii dla ATP, drugiego substratu heksochinazy, składa się zwykle z pięciu arkuszy β i dwóch śmigieł alfa.
Funkcje
Heksochinaza ma transcendentalną funkcję w metabolizmie węglowodanów większości żywych istot, ponieważ katalizuje pierwszy etap trasy glikolitycznej, pośrednicząc w fosforylacji glukozy w środku.
Ten pierwszy etap glikolizy, który składa się z przeniesienia grupy fosforylowej z ATP (dawcy) na glukozę, podając 6-fosforan i glukozę ADP, jest pierwszym z dwóch etapów inwestycji energetycznych w postaci ATP.
Ponadto reakcja katalizowana przez heksochinazę jest przejście „aktywacji” glukozy do późniejszego przetwarzania i stanowi etap „zaangażowania”, ponieważ glukoza w ten sposób fosforylowana nie może opuścić komórki przez jej konwencjonalne transportery w plazmie błonowej.
Może ci służyć: heterogeniczne mieszankiProdukt reakcji katalizowanej przez heksochinazę, to znaczy glukozę 6-fosforanową, jest punktem gałęzi, ponieważ jest to pierwszy substrat stosowany na drodze fosforanu pentozowego i w syntezie glikogenu u wielu zwierząt (i z powodu skrobia na roślinach).
W roślinach
Funkcja heksochinazy w roślinach nie różni się bardzo od funkcji zwierząt lub mikroorganizmów, jednak w górnych roślinach enzym działa również jako „czujnik” stężenia cukru.
Znaczenie tej funkcji w tych organizmach ma związek z udziałem cukrów jako czynników regulacji w ekspresji genów zaangażowanych w różne procesy metaboliczne, takie jak:
- Fotosynteza
- Cykl glioksylanu
- Oddychanie
- Degradacja lub synteza skrobi i sacharozy
- Metabolizm azotu
- Obrona przed patogenami
- Regulacja cyklu komórkowego
- Reakcja lecznicza
- Pygmentacja
- Starzenie, między innymi.
Ta funkcja heksochinazy jako „czujnika” ilości glukozy wewnątrzkomórkowej została również opisana dla drożdży i ssaków.
Kształty
W naturze istnieją różne formy heksochinaz, co zależy zasadniczo od rozważanego gatunku.
Na przykład u człowieka i innych zwierząt kręgowców wykazano istnienie 4 różnych izoform enzymu heksochinazy w przedziale cytozolowym, do którego oznaczono go liczbą rzymską I, II, III i IV.
Izoenzymy, II i III mają 100 kDa masę cząsteczkową, są hamowane przez ich produkt reakcji (glukoza 6-fosforanowa) i są bardzo powiązane z glukozą, to znaczy mają bardzo niską stałą km stałą. Jednak enzymy te mają niewielką specyficzność podłoża, będąc w stanie fosforyzować inne heksozy, takie jak fruktoza i ręka.
Może ci służyć: kwasy: cechy i przykładyIzoenzym IV, znany również jako glikoquinaza (GLCK), ma tylko 50 kDa masę cząsteczkową i pomimo tego, że jest niewielka powiązana (wysokie wartości km), ma wysoką swoistość przez glukozę jako substrat i nie podlega im mechanizmów regulacji, że inne trzy izoenzymy.
Glukochinaza (izoenzym IV heksochinazy wielu ssaków) występuje głównie w wątrobie i pomaga temu narządowi w „regulacji” prędkości zużycia glukozy w odpowiedzi na zmiany tego substratu w krążącym krwi krwi.
Trzy geny, które kodują dla heksochinaz I, II i III u zwierząt, wydają się III tylko na końcu C-końcowym.
Bibliografia
- Aronoff, s. L., Berkowitz, k., Shreiner, ur., I chcę, l. (2004). Metabolizm i regulacja glukozy: poza insuliną i glukagonem. Cukrzyca spektrum, 17(3), 183-190.
- Harrington, g. N., & Bush, D. R. (2003). Budowa rola heksokinazy w metabolizmie i sygnalizacji glukozy. Komórka roślinna, piętnaście(11), 2493-2496.
- Jang, J. C., León, s., Zhou, L., & Sheen, J. (1997). Heksokinaza co do czujnika cukru w wyższych roślinach. Komórka roślinna, 9(1), 5-19.
- Kawai, s., Mukai, t., Mori, s., Mikami, ur., & Murata, K. (2005). Hipoteza: struktury, ewolucja i przodek kinaz glukozy w rodzinie heksokinazy. Journal of Bioscience and Bioingineering, 99(4), 320-330.
- Mathews, k. I. (1998). Van Holde. Biochemia.
- Wilson, J. I. (2003). Izozymy heksokinazy ssaków: struktura, lokalizacja subkomórkowa i funkcja metaboliczna. Journal of Experimental Biology, 206(12), 2049-2057.
- « 13 soków do leczenia zapalenia błony śluzowej żołądka (naturalne i skuteczne)
- Rozbieżne przyczyny ewolucji i przykłady »

