Charakterystyka grupy karbonylowej, właściwości, nomenklatura, reaktywność
- 4257
- 352
- Prokul Woliński
On Grupa karbonylowa Jest to organiczna i natleniona grupa funkcjonalna, która przypomina cząsteczkę gazu tlenku węgla. Jest reprezentowany jako C = O i chociaż jest uważany za organiczny, można go również znaleźć w związkach nieorganicznych; Jak kwas węglowy, H2WSPÓŁ3, lub w związkach organometalicznych z CO jako wiązanie.
Jednak dotyczy chemii dwutlenku węgla, życia, biochemii i innych analogicznych gałęzi naukowych, w których grupa wyróżnia się na swoim ogromnym znaczeniu. Gdyby nie dla niego, wiele cząsteczek nie mogło wchodzić w interakcje z wodą; Białka, cukry, aminokwasy, tłuszcze, kwasy nukleinowe i inne biomolekuły nie istniałyby, gdyby nie to.
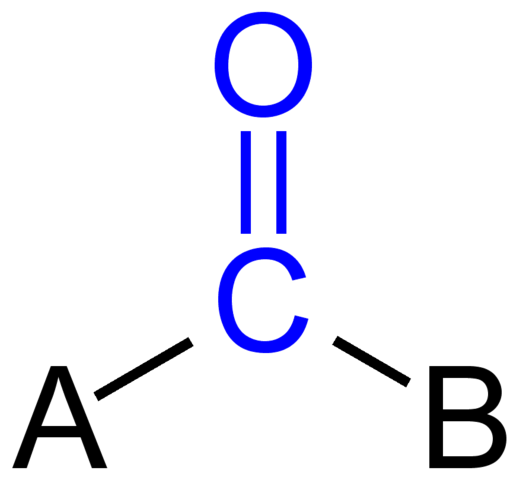
 Grupa karbonylowa. Źródło: Jü [domena publiczna]
Grupa karbonylowa. Źródło: Jü [domena publiczna] Górny obraz pokazuje, jak wygląda ta grupa w ogólnym szkielecie związku. Zauważ, że jest podświetlony przez kolorowy kolor, a jeśli usunęliśmy zamienniki a i b (r lub r ', równie ważne), istniałaby cząsteczka tlenku węgla. Obecność tych podstawników definiuje dużą liczbę cząsteczek organicznych.
Jeśli A i B są atomami węgla, takimi jak metale lub elementy niemetaliczne, można wykonać związki organometaliczne lub nieorganiczne. W przypadku chemii organicznej podstawniki A i B zawsze będą lub atomy wodoru, linie gazowane, z krążącymi lub bez nich pierścieniami cyklicznymi lub aromatycznymi.
Zatem zaczyna rozumieć, dlaczego grupa karbonylowa jest dość powszechna dla tych, którzy badają nauk o naturalne lub zdrowia; Jest wszędzie i bez niego mechanizmy molekularne, które zdarzają się w naszych komórkach.
Gdyby można było podsumować jego znaczenie, powiedzianoby, że zapewnia polaryzację, kwasowość i reaktywność na cząsteczkę. Tam, gdzie istnieje grupa karbonylowa, jest bardziej niż prawdopodobne, że w tym momencie cząsteczka może ponieść transformację. Dlatego strategicznym miejscem jest rozwijanie syntezy organicznej poprzez utlenianie lub ataki nukleofilowe.
[TOC]
Charakterystyka i właściwości grupy karbonylowej
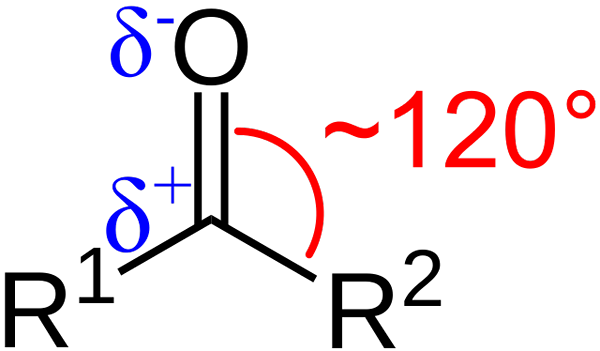 Charakterystyka strukturalna grupy karbonylowej. Źródło: Azaline Gomberg [domena publiczna].
Charakterystyka strukturalna grupy karbonylowej. Źródło: Azaline Gomberg [domena publiczna]. Jakie są cechy strukturalne i elektroniczne grupy karbonylowej? W górę1 i r2 zamiast A i B, które istnieją między podstawnikami a atomem tlenu, kąt 120 ° C; To znaczy geometria wokół tej grupy jest płaska trygonalna.
Jaka jest taka geometria2; Tak więc węgiel będzie miał trzy orbitale SP2 Aby utworzyć proste kowalencyjne linki z R1 i r2, i orbital P czyste, aby ustalić podwójne wiązanie z tlenem.
W ten sposób wyjaśniono, w jaki sposób może być podwójne wiązanie c = o.
Jeśli obraz jest obserwowany, okaże się również, że tlen ma większą gęstość elektroniczną, δ-, niż węgiel, δ+. Wynika to z faktu, że tlen jest bardziej elektrowni niż węgiel, a zatem „kradnie” gęstość elektroniczną; I nie tylko dla niego, ale także dla podstawników r1 i r2.
W konsekwencji generuje się stały moment dipolowy, który może mieć większą lub mniejszą wielkość w zależności od struktury molekularnej. Gdzie jest grupa karbonylowa, będą momenty dipolowe.
Struktury rezonansowe
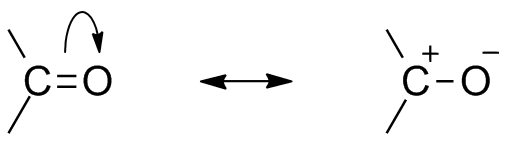 Dwie struktury rezonansowe dla tej grupy organicznej. Źródło: Mfomich [CC0]
Dwie struktury rezonansowe dla tej grupy organicznej. Źródło: Mfomich [CC0] Kolejną konsekwencją elektroungatywności tlenu jest to, że w grupie karbonylowej istnieją struktury rezonansowe, które definiują hybrydę (kombinacja dwóch struktur górnego obrazu). Zauważ, że para elektronów może migrować na orbital P tlenu, który pozostawia atom węgla o dodatnim obciążeniu częściowym; Karbokacja.
Może ci służyć: cykloalcanos: właściwości, reakcje, zastosowania, przykładyObie struktury zdarzają się stale, więc węgiel utrzymuje stały niedobór elektronów; to znaczy w przypadku kationów, które są bardzo bliskie, doświadczą odpychania elektrostatycznego. Ale jeśli jest to anion lub gatunek zdolny do przekazywania elektronów, poczuje się silnym przyciąganiem tego węgla.
Wtedy pojawia się to, co jest znane jako atak nukleofilowy, co zostanie wyjaśnione w następnym rozdziale.
Nomenklatura
Gdy związek ma grupę C = O, mówi się, że jest to karbonyl. Zatem, w zależności od charakteru związku karbonylowego, ma własne zasady nomenklatury.
Chociaż, niezależnie od tego, co jest wspólna zasada: C = O ma pierwszeństwo w łańcuchu gazowanym w momencie wymienienia atomów węgla.
Oznacza to, że jeśli występują konsekwencje, atomy halogenowe, grupy funkcjonalne azotu, podwójne lub potrójne łącza, żaden z nich nie może niosnąć mniejszej liczby niż C = O; Dlatego najdłuższy łańcuch zaczyna być wymieniony jak najbliżej grupy karbonylowej.
Jeśli wręcz przeciwnie, istnieje kilka C = lub w łańcuchu, a jeden z nich jest częścią funkcjonalnej grupy większej hierarchii, grupa karbonylowa będzie nosić większy lokalizator i będzie wymieniony jako podstawnik oxo.
A co mówi hierarchia? Następujące, od najwyższego do małoletniego:
-Kwasy karboksylowe, RCOOH
-Ester, rcoor '
-Amida, Rconh2
-Aldehyd, RCOH (lub RCHO)
-Cetona, Rcor
Zastępowanie r i r 'segmentami molekularnymi, niekończące się związki karbonylowe reprezentowane przez rodziny powyżej: kwasy karboksylowe, estry, objadi itp. Każdy z nich powiązał swoją tradycyjną nomenklaturę lub IUPAC.
Reaktywność
Atak nukleofilowy
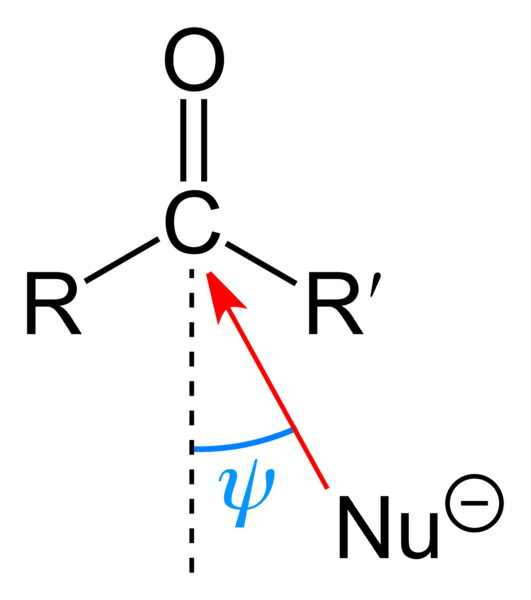 Atak nukleofilowy na grupę karbonylową. Źródło: Benjah-BMM27 [domena publiczna]
Atak nukleofilowy na grupę karbonylową. Źródło: Benjah-BMM27 [domena publiczna] Górny obraz pokazuje atak nukleofilowy. Nukleofil, nu-, Może to być anion lub gatunek neutralny z dostępnymi elektronami; Jak amoniak, NH3, Na przykład. Wygląda to wyłącznie na węgiel, ponieważ według struktur rezonansowych przedstawia dodatnie obciążenie częściowe.
Obciążenie dodatnie przyciąga NU-, które będą starać się zbliżyć do „flanki”, tak że istnieje najmniejsze przeszkody steryczne przez podstawniki r i r '. W zależności od tego, jak bardzo są nieporęczne lub wielkość tego samego Nu-, Atak nastąpi pod różnymi kątami ψ; Może być bardzo otwarty lub zamknięty.
Gdy atak nastąpi, powstanie związek pośredniego, nu-cr'-o-; to znaczy, tlen pozostaje z kilkoma elektronami, aby umożliwić dodanie NU- do grupy karbonylowej.
Ten negatywnie obciążony tlen może interweniować w innych etapach reakcji; proton jako grupa hydroksylowa, OH lub uwalnia.
Może Ci służyć: współczynnik partycji: dystrybucja, dystrybucja, aplikacjeZaangażowane mechanizmy, a także produkty reakcji uzyskane przez ten atak, są bardzo zróżnicowane.
Pochodne
Nurycki agent nu- Może to być wiele gatunków. Dla każdego specyficznego dla reakcji z grupą karbonylową różne pochodne.
Na przykład, gdy wspomniany środek nukleofilowy jest aminą, NH2A, Iminas, r. R2C = nr; Jeśli jest to hydroksyloamina, NH2Och, powoduje oxymas, rr'c = noh; Jeśli jest to anion cyjanku, CN-, Cianohydrinas, rr'c (oh) cn, a zatem z innymi gatunkami.
Zmniejszenie
Początkowo powiedziano, że ta grupa jest natleniona, a zatem zardzewiała. Oznacza to, że biorąc pod uwagę warunki, łącza można zmniejszyć lub stracić atom tlenu, zastępując go hydrogenami. Na przykład:
C = o => ch2
Ta transformacja wskazuje, że grupa karbonylowa została zredukowana do grupy metylenowej; Wystąpił wzrost wodoru z powodu utraty tlenu. W bardziej odpowiednich terminach chemicznych: związek karbonylowy jest redukowany do alkan.
Jeśli jest to Cetona, rcor ', w obecności hydraracina, h2N-NH2, i mocno podstawowe środowisko można sprowadzić do odpowiedniego alkan; Ta reakcja jest znana jako redukcja Wolff-Kishnera:
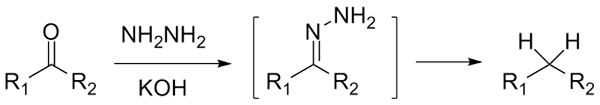 Wolff-Kishner Redukcja. Źródło: Jü [CC0]
Wolff-Kishner Redukcja. Źródło: Jü [CC0] Jeśli z drugiej strony mieszanina reakcyjna składa się z amalgamatu cynku i kwasu solnego, reakcja jest znana jako redukcja Clemmensen:
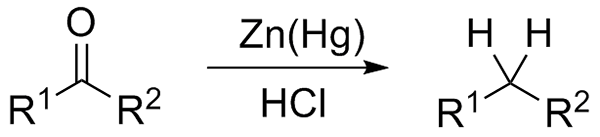 Redukcja Clemmensen. Źródło: Wikimedia Commons.
Redukcja Clemmensen. Źródło: Wikimedia Commons.
Trening acetal i CEAL
Grupa karbonylowa może nie tylko dodać czynniki nukleofilowe Nu-, ale w warunkach kwasowych może również reagować z alkoholi.
Kiedy aldehyd lub cetona częściowo reagują z alkoholem, odpowiednio hemiacetale lub hemicetale. Jeśli reakcja jest przeprowadzana całkowicie, produkty są acetalami i ketalami. Poniższe równania chemiczne podsumowują i wyjaśniają nowo wspomniane:
RCHO + r3Oh G rchoh (lub3) (Hemiacetal) + r4Oh G RCH (lub3) (Lub4) (Acetal)
RCOR2 + R3Oh G rcor2(Och) (lub3) (Hemical) + r4Oh G rcor2(Lub3) (Lub4) (Ketal)
Pierwsza reakcja odpowiada tworzeniu się hemicetalów i acetalów z aldehydu, a drugą z hemicetalów i ketalów z ketonu.
Równania te nie są wystarczająco proste, aby wyjaśnić tworzenie tych związków; Jednak dla pierwszego podejścia do tematu wystarczy zrozumieć, że alkohole są dodawane i że ich łańcuchy boczne r (r (r (r (r3 i r4) Są one powiązane z węglem karbonylowym. Dlatego lub lub3 i lub4 Do początkowej cząsteczki.
Główną różnicą między acetal a ketal jest obecność atomu wodoru związanego z węglem. Zauważ, że keton brakuje tego wodoru.
Chłopaki
Bardzo podobne, jak wyjaśniono w sekcji nomenklatury dla grupy karbonylowej, jej typy oparte są na podstawie A i B, lub R i R '. Dlatego istnieją cechy strukturalne, które dzielą serię związków karbonylowych poza tylko rzędem lub typem linków.
Na przykład wspomniano o zasadzie analogii między tą grupą a tlenkiem węgla, C≡O. Jeśli cząsteczka jest pozbawiona atomów wodoru i jeśli występują również dwa zaciski C = O, będzie to tlenek węglowy, CNALBO2. Dla n równych 3, będziesz mieć:
Może ci służyć: IsóbarosO = c = c = c = o
Co jest tak, jakby były dwie cząsteczki C≡O powiązane i oddzielone węglem.
Związki karbonylowe mogą nie tylko pochodzić z gazu CO, ale także z kwasu węglowego, h2WSPÓŁ3 lub OH- (C = O) -OH. Tutaj dwa OH reprezentują R i R ', i zastąpienie jednego z nich lub ich hydrogenów, uzyskuje się pochodne kwasu węglanowego.
A potem istnieją pochodne kwasów karboksylowych, RCOOH, uzyskane przez zmianę tożsamości R lub zastępowanie H innym atomem lub łańcuchem R '(które spowodowałoby powstanie estra, rcoor').
Jak to zidentyfikować w aldehydo i ketonach
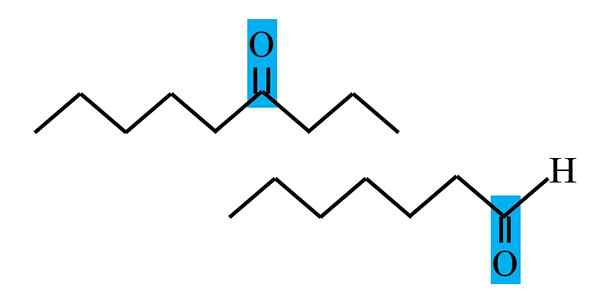 Różnicowanie ketonu i aldehydu od formuły strukturalnej. Źródło: Gabriel Bolívar.
Różnicowanie ketonu i aldehydu od formuły strukturalnej. Źródło: Gabriel Bolívar. Zarówno aldehydo, jak i ketony mają wspólną obecność grupy karbonylowej. Jego właściwości chemiczne i fizyczne są z tego powodu. Jednak ich środowiska molekularne nie są równe w obu związkach; W tym pierwszym jest on w końcowej pozycji, aw sekundach, w dowolnym miejscu w łańcuchu.
Na przykład na górnym obrazie grupa karbonylowa znajduje się wewnątrz niebieskawego pudełka. W ketonach obok tego pudełka musi znajdować się inny segment węglowy lub łańcucha (do góry nogami); Podczas gdy w aldehydach może być tylko atom wodoru (poniżej).
Jeśli C = O jest na jednym końcu łańcucha, będzie to aldehyd; To najbardziej bezpośredni sposób na odróżnienie go od cetony.
ID
Ale jak wiedzieć eksperymentalnie, czy nieznany związek jest aldehydem czy ketonem? Istnieje wiele metod spektroskopowych (wchłanianie promieniowania w podczerwieni, IR) lub organicznych testów jakościowych.
Jeśli chodzi o eseje jakościowe, opierają się one na reakcjach, które przy udzielaniu pozytywnego analityka obserwuje odpowiedź fizyczną; Zmiana koloru, uwalnianie ciepła, tworzenie bąbelków itp.
Na przykład dodanie do próbki roztwór kwasu k2Cr2ALBO7 Aldehyd zostanie przekształcony w kwas karboksylowy, co powoduje, że kolor roztworu zmienia się z pomarańczowej na zielony (test pozytywny). Tymczasem ketony nie reagują, a zatem analityk nie obserwuje żadnej zmiany koloru (test ujemny).
Innym badaniem jest użycie odczynnika Tollens [AG (NH3)2]+, tak, że aldehyd zmniejszał katacje Ag+ na metal srebrny. I wynik: tworzenie srebrnego lustra na dole rurki testowej, w której umieszczono próbkę.
Główne przykłady
Wreszcie wymieniono serię przykładów związków karbonylowych:
-Ch3COOH, kwas octowy
-HCOOH, kwas mrówkowy
-Ch3Coch3, Propanona
-Ch3Coch2Ch3, 2-butanon
-C6H5Coch3, acetofenon
-Ch3Cho, Etanal
-Ch3Ch2Ch2Ch2Cho, Pentanal
-C6H5Cho, Benzaldehyd
-Ch3Conh2, acetamid
-Ch3Ch2Ch2Cooch3, Octan propylu
Teraz, jeśli cytowane są przykłady związków, które po prostu posiadają tę grupę, lista byłaby prawie nieograniczona.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. Aminy. (10. edycja.). Wiley Plus.
- Reid Danielle. (2019). Grupa karbonylowa: właściwości i przegląd. Badanie. Odzyskane z: Study.com
- Sharleen Agvateesiri. (5 czerwca 2019). Grupa karbonylowa. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Wiki Kids Ltd. (2018). Związki karbonylowe. Odzyskane od: po prostu.Nauka
- TOPPR. (S.F.). Nomenklatura i struktura grupy karbonylowej. Odzyskane z: toppr.com
- Clark J. (2015). Utlenianie aldehydów i ketonów. Odzyskane z: chemguide.współ.Wielka Brytania

