Funkcje nadmierne, główne transportery glukozy
- 2093
- 190
- Prokul Woliński
Nadmiar Są serią transporterów typu bramki, odpowiedzialnych za przeprowadzanie pasywnego transportu glukozy do cytozolu szerokiej gamy komórek ssaków.
Jednak większość zidentyfikowanych do tej pory nie jest specyficzna dla glukozy. Przeciwnie, są one zdolne do transportu różnych cukrów, takich jak ręka, galaktoza, fruktoza i glukozamina, a także inne rodzaje cząsteczek, takie jak uratozytol i manozytol.
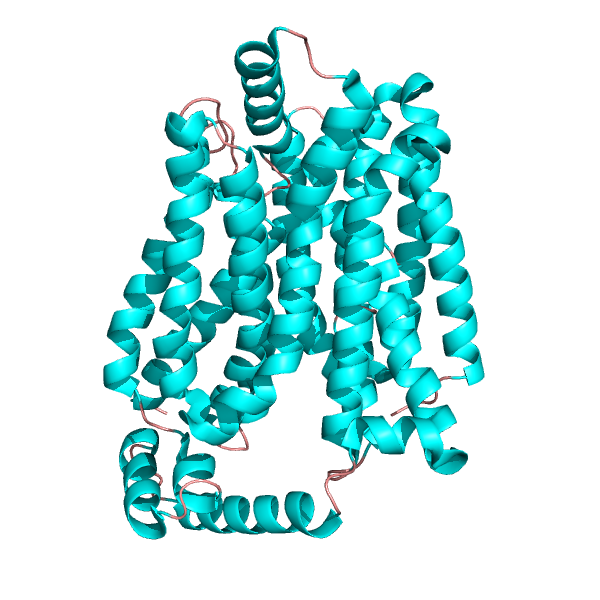
 Typowa struktura przewoźnika glukozy. Przez A2-33 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)], z Wikimedia Commons.
Typowa struktura przewoźnika glukozy. Przez A2-33 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)], z Wikimedia Commons. Do tej pory zidentyfikowano co najmniej 14 nadmiaru. Wszystkie mają wspólne cechy strukturalne i różnią się zarówno rozkładem tkanki, jak i typu cząsteczki, która transportuje. Tak więc wydaje się, że każdy typ jest dostosowany do różnych warunków fizjologicznych, gdzie należy wypełnić określoną rolę metaboliczną.
[TOC]
Mobilizacja glukozy wewnątrz komórek
Większość żywych komórek zależy od częściowego lub całkowitego utleniania glukozy w celu uzyskania niezbędnej energii do wykonania ich istotnych procesów.
Wejście tej cząsteczki do cytosolu komórki, miejsce, w którym jest ona metabolizowana, zależy od pomocy przenośników białek, ponieważ jest wystarczająco duża i polarna, aby móc przekroczyć samą dwuwarstwę lipidową.
W komórkach eukariotycznych zidentyfikowano dwa duże rodzaje transporterów zaangażowanych w mobilizację tego cukru: Cotransporterów Na+/Glukozę (SGLT) i jednoporterów GLUT.
Ten pierwszy używa wtórnego aktywnego mechanizmu transportu, w którym Na+ Cotransport. Podczas gdy ten ostatni wykonuje ułatwiony ruch pasywny, mechanizm, który nie wymaga energii i występuje na korzyść gradientu stężenia cukru.
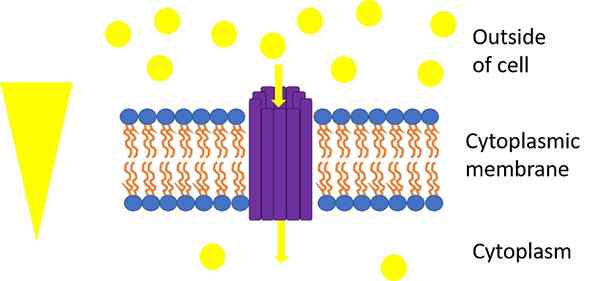 Mechanizm transportowy stosowany przez transportery heksozy. Autor: Emma Dittmar - Own Work, CC przez -sa 4.0, https: // commons.Wikimedia.org/w/indeks.Php?Curid = 64036780
Mechanizm transportowy stosowany przez transportery heksozy. Autor: Emma Dittmar - Own Work, CC przez -sa 4.0, https: // commons.Wikimedia.org/w/indeks.Php?Curid = 64036780 Transporterzy nadużytymi
Transportery glut, dla akronimu w języku angielskim „transporterów glukozy”, to grupa transporterów bramkowych odpowiedzialnych za przeprowadzanie pasywnego transportu glukozy z pożywki pozakomórkowej do cytosolu.
Może ci służyć: flagelos: eukaryota, procariota (struktura i funkcje)Należą one do wielkiej nadrodziny ułatwionych transporterów dyfuzyjnych (MSF), złożonych z dużej liczby transporterów odpowiedzialnych za przeprowadzanie transportu transbłonowego szerokiej gamy małych organicznych cząsteczek organicznych.
Chociaż jego nazwa wydaje się wskazywać, że transportują tylko glukozę, transportery te mają zmienne specyficzność dla różnych monosacharydów sześciu atomów węgla. Dlatego zamiast transporterów glukozy, są oni transporterami sześciokątnymi.
Do tej pory zidentyfikowano co najmniej 14 nadmiaru, a jego lokalizacja wydaje się być specyficzna tkanina u ssaków. To znaczy, że każda izoforma jest wyrażana w bardzo konkretnych tkaninach.
W każdej z tych tkanek cechy kinetyczne tych transporterów różnią się znacznie. Ten ostatni wydaje się wskazywać, że każdy z nich ma na celu reagowanie na różne potrzeby metaboliczne.
Struktura
14 nadmiar, którym udało się zidentyfikować do tej pory, przedstawia serię wspólnych cech strukturalnych.
Wszystkie są kompleksowymi białkami błony wielofunkcyjnej, to znaczy biway lipidowej.
Sekwencja peptydowa tych transporterów waha się między 490-500 odpadami aminokwasowymi, a ich trójwymiarowa struktura chemiczna jest podobna do tej zgłoszonej dla wszystkich innych członków głównego superrodziny facylitatora (MSF).
Struktura ta charakteryzuje się przedstawieniem 12 segmentów transmarketów w konfiguracji α i wysoce glikozylowanej domeny pozakomórkowej, która, w zależności od rodzaju klafiki, może być zlokalizowana w trzeciej lub piątej pętli utworzonej pętli.
Dodatkowo końce aminowe i końcowe białko karboksylowe są zorientowane na cytosol i mają pewien stopień pseudosymetrii. Sposób, w jaki te skrajności są dostępne przestrzennie, powoduje powstanie otwartej wnęki, która stanowi miejsce połączenia glukozy lub do transportu dowolnego innego monosacharydu.
W tym sensie forma porów. Wszystkie te obecne w jednej z ich twarzy o wysokiej gęstości odpadów polarnych, które ułatwiają tworzenie wewnętrznego hydrofilowego środowiska porów.
Może ci służyć: adiponektynaKlasyfikacja
Glut został sklasyfikowany w trzech głównych klasach w oparciu o stopień podobieństwa sekwencji peptydowej, a także położenie domeny glikozylowanej.
Gluts należące do klasy I i II ograniczają wysoce glikozylowaną domenę do pierwszej pętli pozakomórkowej znajdującej się między dwoma pierwszymi segmentami transbłonowymi. Podczas gdy w klasie III jest ograniczona do dziewiątej pętli.
W każdej z tych klas odsetek homologii między sekwencjami peptydowymi wynosi od 14 do 63% w mniej zachowanych obszarach i od 30 do 79% w wysoce zachowanych regionach.
Klasa I składa się z transporterów GLUT1, GLUT2, GLUT3, GLUT. Klasa II dla Glut5, 7, 9 i 11. Oraz klasa III dla GLUT6, 8, 10 i 12 i 13.
Ważne jest, aby wspomnieć, że każdy z tych transporterów ma lokalizacje, cechy kinetyczne, specyficzność podłoża i funkcje.
Główne transportery glukozy i funkcji
Glut1
Jest wyrażany głównie w erytrocytach, komórkach mózgowych, łożysku i nerkach. Chociaż jego główną funkcją jest dostarczenie tych komórek poziomów glukozy niezbędnych do wytrzymania oddychania komórkowego, jest on odpowiedzialny za transport innych węglowodanów, takich jak galaktoza, ręka i glukozamina.
Glut2
Chociaż jest wysoce specyficzny dla glukozy, Glut2 stanowi większe powinowactwo do glukozaminy. Jest jednak w stanie przetransportować fruktozę, galaktozę i rękę do cytosolu wątroby, komórek trzustki i nerki nabłonka jelita cienkiego.
Glut3
Chociaż ma wysokie powinowactwo do glukozy, GLUT3 jednoczy i transportuje z mniejszym powinowactwem galaktozy, ręką, maltozą, ksylozą i kwasem kwaśnym.
Jest wyrażany głównie w komórkach zarodkowych, więc utrzymuje ciągły transport tych cukrów z łożyska do wszystkich komórek płodu. Ponadto został wykryty w komórkach mięśni i jąder.
Glut4
Przedstawia wysokie powinowactwo do glukozy i jest wyrażany tylko w tkankach wrażliwych na insulinę. Dlatego wiąże się to z transportem glukozy stymulowanej przez ten hormon.
Może ci służyć: łańcuch przenośnika elektronów: składniki, sekwencja, inhibitoryGlut8
Transportuje zarówno glukozę, jak i fruktozę do wnętrza wątroby, nerwowej, sercowej, jelit, komórek tłuszczowych.
Glut9
Oprócz transportu glukozy i fruktozy, ma ono wysokie powinowactwo do moczów, więc wchłanianie ich w komórkach nerkowych pośredniczy. Stwierdzono jednak, że jest również wyrażany w leukocytach i komórkach jelita cienkiego.
Glut12
W mięśniach szkieletowych transporter ten jest tłumaczony na błonę plazmatyczną w odpowiedzi na insulinę, więc działa w mechanizmach reagowania na ten hormon. Jego ekspresję określono również w komórkach prostaty, łożysku, nerkach, mózgu i gruczołach sutkowych.
Glut13
Przeprowadza specyficzny transport miozytolu i wodoru. Dzięki temu pomaga zmniejszyć pH płynu mózgowo -rdzeniowego do wartości zbliżonych do 5.0 przez komórki nerwowe, które integrują móżdżek, podwzgórze, hipokamp i trzon mózgu.
Bibliografia
- Augustin r. Krytyczna recenzja. Rodzina białek fasbroratorów transportu glukozy: nie tylko chodzi o. IUBMB Life. 2010; 62 (5): 315-33.
- Bell GI, Kayano T, Bus JB, Burant CF, Takeda J, Lin D, Fukumoto H, Seino S. Biologia molekularna ssaków transporterów glukozy. Care Diabetes. 1990; 13 (3): 198-208.
- Castrejón V, Carbó R, Martínez M. Mechanizmy molekularne zaangażowane w transport glukozy. Reb. 2007; 26 (2): 49-57.
- Joost HG, Thorens B. Rozszerzone fatutatory transportu cukru/poliolu: nomenklatura, charakterystyka sekwencji i potencjalna funkcja jej nowych członków (przegląd). Mol Memb Biol. 2001; 18 (4): 247-56.
- Kinnamon SC, palcem TE. Smak do ATP: Neurotransion in Buds. Neurosci z komórek przednich. 2013; 7: 264.
- Scheepers A, Schmidt S, Manolesc A, Cheeseman CI, Bell A, Zahn C, Joost HG, Schürmann A. Charakterystyka ludzkiego genu SLC2A11 (GLUT11): alternatywne użycie promotora, funkcja, ekspresja i rozkład subkomórkowy trzech isform i brak mysiego ortologa. Mol Memb Biol. 2005; 22 (4): 339-51.
- Schürmann a. Wgląd w „dziwne” heksos transportas Glut3, Glut5 i Glut7. Am J Physiol Endocrinol Metab. 2008; 295 (2): E225-6.
- Thorens B, Mueckler M. Transportery glukozy w XXI wieku. Am J Physiol Endocrinol Metab. 2010; 298 (2): E141-145.
- Yang H, Wang D, Engelstad K, Bagay L, Wei i, Rotstein M, Aggarwal V, Levy B, Ma L, Chung WK, Vivo DC. Zespół niedoboru GLUT1 i test wychwytu glukozy erytrocytów. Ann Neurol. 2011; 70 (6): 996-1005.
- « Charakterystyka nanche, siedlisko, właściwości, przepisy na gotowanie
- Charakterystyka białych tygrysów, dystrybucja, reprodukcja, jedzenie »

