Szkolenie glukozydy, funkcje i typy/grupy
- 3458
- 286
- Filip Augustyn
Glukozydy Są to wtórne metabolity roślin, które są przymocowane do mono oligosacharydów za pomocą linków glukozydowych, to znaczy, że są to metabolity glikozylowane. Należą do chemicznej rodziny glikozydów, które obejmują wszystkie związki chemiczne przymocowane do słodyczy.
W typowej strukturze cząsteczki glikozydowej rozpoznawane są dwa regiony: algikon i glikon. Region złożony z pozostałości sacharydowej nazywa się glycona, a region odpowiadający cząsteczce niesacharydowej jest znany jako część aglikonu.
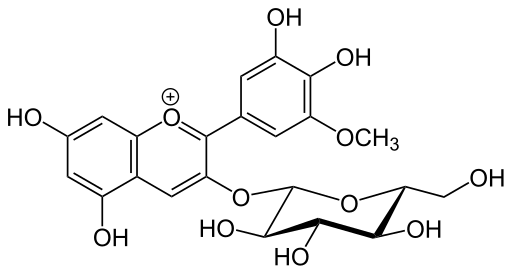
 Struktura glikozydu (źródło: Yikrazuul [domena publiczna] za pośrednictwem Wikimedia Commons)
Struktura glikozydu (źródło: Yikrazuul [domena publiczna] za pośrednictwem Wikimedia Commons) Zwykle termin „glukozyd” jest stosowany w odniesieniu do faktu, że podczas hydrolizy tych związków cząsteczki glukozy są jednak uwalniane, członkowie tej samej rodziny cząsteczek mają odpady z innych rodzajów cukrów, takich jak Ramnosa, galaktoza lub ręczne , pośród innych.
Nomenklatura glukozydów zazwyczaj oznacza charakter jego regionu aglikonu. Te nazwy z zakończeniem „-ina” są zarezerwowane dla związków azotowych, podczas gdy alkaloidy są nazwane sufiksem „-ocyd”.
Sufiksy te często towarzyszą korzeni łacińskiej nazwy pochodzenia botanicznego, w którym cząsteczki są opisywane po raz pierwszy i zwykle dodaje się przedrostek „gluco-”.
Wiązanie glukozydowe między częściami glikonu i aglikonu może wystąpić między dwoma atomami węgla (C-glukozydy) lub atomy tlenu mogą uczestniczyć (ALBO-glukozydy), od których jego stabilność będzie zależeć od hydrolizy chemicznej lub enzymatycznej.
Względna liczebność glikozydów w okrytozalążkach jest znacznie większa niż w gimnospermie i wykazano, że w odniesieniu do monokotyedonowych i diakotydonów, z pewnymi wyjątkami, nie ma dużej różnicy w ilości i rodzajach glukozydów, które są znalezione.
Ważne jest, aby podkreślić wielką różnorodność i heterogeniczność tej grupy związków, ponieważ tożsamość każdego z nich będzie zależeć od części agliczonowej, która jest niezwykle zmienna.
[TOC]
Szkolenie
Biosynteza lub tworzenie związków glukozydowych (Peng, Peng, Kawagoe, Hogan i Delmer, 2002) w roślinach zależy od rodzaju glukó, który jest brany pod uwagę, a u roślin jego wskaźniki biosyntezy zależą często, często warunki na warunkach środowiskowych.
Na przykład cyjanogenne glikozydy są syntetyzowane z prekursorów aminokwasów, w tym L-marozyny, L-woliny, L-izoleucyny i L-fenyloalaniny. Aminokwasy są hydroksylowane N-Aminokwasy hydroksylowe, które są następnie przekształcane w aldaksimas, które są następnie przekształcane w nitryle.
Może ci służyć: rodzime rośliny PeruNitryle są hydroksylowane z tworzeniem α-hydroksyntrilosu, które można glikozylować z powodu odpowiedniego cyjanogennego glucóside. Dwa wielofunkcyjne cytochromy znane jako enzymy p450 i glikozylotransferazy są zaangażowane w tę trasę biosyntetyczną.
W przeważającej części trasy biosyntetyczne glukozydów sugerują uczestnictwo enzymów glikozylotransferazy, które są zdolne do selektywnego przenoszenia odpadów węglowodanów z pośredniej cząsteczki UDP, do odpowiedniej części agliczonowej.
Przeniesienie aktywowanych cukrów, takich jak UDP-glukoza, do części akceptora aglikonu, pomaga ustabilizować, detoksykację i rozpuszczanie metabolitów w końcowych etapach wtórnych metabolitów produkujących trasy.
Są to zatem enzymy glikozylotransferazy odpowiedzialne za dużą różnorodność glukozydów w roślinach i dlatego zostały szeroko badane.
Niektóre metody syntetyczne In vitro istnieją do uzyskania pochodnych glikozydowych roślin, które sugerują systemy odwrotnej hydrolizy lub trans Glikozylacja związków.
Funkcjonować
Na przykład w roślinach jedna z głównych funkcji glikozydów flawonoidalnych ma związek z ochroną przed światłem ultrafioletowym, przed owadami i grzybami, wirusami i bakteriami. Służą jako przeciwutleniacze, atrakcyjne zapylacze i kontrolery hormonów roślinnych.
Inne funkcje glukozydów flawonoidalnych obejmują stymulację produkcji guzków przez bakteryjne gatunki z rodzaju Rhizobium. Mogą uczestniczyć w enzymatycznych procesach hamowania i jako środki allelopatyczne. Zatem zapewniają również roślinożerną barierę chemiczną.
Wiele glukozydów, po hydrolizie, generuje reszty glukozy, które mogą być stosowane przez rośliny jako substrat metaboliczny do produkcji energii lub nawet do tworzenia związków znaczenia strukturalnego w komórkach.
Antropocentralnie mówiąc, funkcja tych związków jest bardzo zróżnicowana, ponieważ podczas gdy niektóre są zatrudnione w przemyśle spożywczym, inne są stosowane w farmaceucie do projektowania leków w leczeniu nadciśnienia, zaburzeń krążenia, środków przeciwnowotworowych itp.
Typy/grupy
Klasyfikację glikozydów można znaleźć w literaturze opartej na częściach nie-sacharydowych (AGLICONAS) lub w odniesieniu do pochodzenia botanicznego. Poniżej znajduje się forma klasyfikacji oparta na części Aglicone.
Główne grupy glikozydów odpowiadają glukozydom sercowym, glikozydom cyjanogennym, glukozynolanom, saponinom i glikozydom antrachinonowym. Niektóre flawonoidy również występują również jako glukozydy.
Może ci służyć: Begonia Rex: Charakterystyka, siedlisko, odmiany, reprodukcja, opiekaGlukozydy serca
Cząsteczki te składają się ogólnie z cząsteczki (region aglikonu), której strukturą jest steryd. Są obecne w roślinach rodziny Scrophulariace, szczególnie w Digitalis Purpurea, a także w rodzinie Convealiaceae z Majalis zwoła się Jako klasyczny przykład.
Ten typ glucóside ma hamujący negatywny wpływ na pompy atasy sodu/potasu w błonach komórkowych, które są szczególnie obfite w komórkach serca, więc przyjmowanie roślin z tymi związkami wtórnymi ma bezpośredni wpływ na serce; Stamtąd jego imię.
Cyjanogenne glukozydy
Są one chemicznie zdefiniowane jako glikozydy α-hydroksy nitilos, które pochodzą z związków aminokwasowych. Są one obecne w gatunkach okrytozalążkowych z rodziny trosaceae, szczególnie w gatunkach rodzaju Prunus, a także w rodzinie Poaceae i innych.
Ustalono, że są one częścią charakterystycznych toksycznych związków niektórych odmian Bugfle Manihot, Najbardziej znany w Ameryce Południowej jako maniok, maniok lub maniok. Podobnie są obfite w nasionach jabłek i orzechów, takich jak migdały.
Hydroliza tych wtórnych metabolitów kończy się na wytwarzaniu kwasu cyjanhydowego. Gdy hydroliza jest enzymatyczna.
Część glikonu cyjanogennych glikozydów jest zazwyczaj D-glikozą, chociaż była również gentobiojna, premiera i inne, głównie zjednoczone przez β-glukozydyczne powiązania.
Spożycie roślin z cyjanogennymi glikozydami może mieć negatywne skutki, wśród których jest zakłócenia w stosowaniu jodu, co powoduje niedoczynność tarczycy.
Glukozynoluty
Podstawą jego struktury aglikonowej składa się z aminokwasów zawierających siarkę, dzięki czemu można je również nazwać tioglukozydami. Główną rodziną roślin związanych z produkcją glukozynolanów jest rodzina Brassicaceae.
Wśród negatywnych skutków organizmów spożywczych tych roślin jest bioaktywacja wątroby prokarcinogenów środowiskowych, która jest wynikiem złożonego wpływu na izoform cytochromu P450. Ponadto związki te mogą podrażniać skórę i indukować niedoczynność tarczycy i dny moczanowej.
Saponiny
Wiele związków „trenerów mydlania” to glukozydy. Ablikonowa część saponin glukozydowych składa się ze sterydów pentacyklicznych lub tetraicznych. Są strukturalnie heterogeniczne, ale mają wspólne cechy funkcjonalne.
W swojej strukturze mają wysoce hydrofilowe glikony i silnie hydrofobowe regiony aglicon, które zapewniają właściwości emulgatora, dzięki czemu można je stosować jako detergenty.
Może ci służyć: wspólny dąb: cechy, siedlisko, dystrybucja, uprawaSaponiny są obecne w szerokiej gamie rodzin roślinnych, w tym gatunki należące do rodziny liliaceae, zilustrowane u gatunku NARTHECIUM OSSISIFRAGU.
Glukozydy antraquinone
Są one mniej powszechne w królestwie roślin w odniesieniu do innych wymienionych wyżej glikozydów. Są obecne w Rumex Crispus i gatunki rodzaju Katar. Wpływ jego spożycia odpowiada przesadnego wydzielania wody i elektrolitów w towarzystwie perystaltyki w okrężnicy.
Flawonoidy i pro-rantocyjany
Wiele flawonoidów i ich oligomer. Pigmenty te są bardzo powszechne w większości królestwa roślin, z wyjątkiem glonów, grzybów i niektórych Antoceros.
Mogą istnieć w naturze jako c-u-glukozydy, w zależności od charakteru wiązania glukozydowego, które występuje między glikonem i regionami algikonu, więc niektóre są bardziej odporne na hydrolizę chemiczną niż inne.
Struktura aglikonu flawonoidów C-glukozydów odpowiada trzem pierścienie z pewną grupą fenolową, która zapewnia im charakterystykę przeciwutleniającą. Związek grupy sacharydowej w regionie aglikonu występuje poprzez wiązania węglowe węglowe między anomerycznym węglem cukru a węglem C6 lub C8 flawonoidalnego jądra aromatycznego.
Bibliografia
- Conn, e. I. (1979). Biosynteza glikozydów cyjanogennych. NaturWissenschaften, 66, 28-34.
- Forslund, k., Morant, m., Jørgensen, ur., Olsen, c. I., Asamizu, e., & Sato, s. (2004). Biosynteza glikozydów nitrylowych rodiocyjanozydu do i D oraz cyjanogenne glikozydy lotustraliny i linamaryny w Lotus japonicus. Fizjologia roślin, 135(Maj), 71-84.
- Markham, k. R. (1989). Metody w biochemii roślinnej. 6. Flawony, flawonole i ich glikozydy (Tom. 1). Academic Press Limited. Pobrano z www.Dx.doi.Org/10.1016/B978-0-12-461011-8.50012-3
- Peng, L., Peng, L., Kawagoe i., Hogan, s. 1., Delmer, d. (2002). B-glukozyd sitosterol jako pierwszy dla syntezy celulozy w roślinach. Nauka, 295, 147-150.
- Richman, a., Swanson, a., Humphrey, t., Chapman, r., McGarvey, ur., POCS, r., & Brandle, J. (2005). Genomika funkcjonalna odkrywa trzy glukozylotransferazy zaangażowane w syntezę głównych słodkich glikozydów Stevia repaudiana. The Plant Journal, 41, 56-67.
- Swain, t. (1963). Taksonomia roślin chemicznych. Londyn: Academic Press.
- Van Rantwijk, F., Oosterom, m. W., & Sheldon, r. DO. (1999). Katalizowana glikozydaza synteza glikozydów alkilowych. Journal of Molecular Catalysis B: Enzymatic, 6, 511-532.
- Vetter, J. (2000). Glikozydy cyjanogenne rośliny. Toksykon, 38, 11-36.
- Wolfenden, r., Lu, x., & Young, G. (1998). Spontaniczna hydroliza glikozydów. J. JESTEM. Chem. Soc., 120, 6814-6815.
- « Oksydacyjne etapy fosforylacji, funkcje i inhibitory
- Wpływ społeczny, ekonomiczny i środowiskowy inżynierii genetycznej »

