Oksydacyjne etapy fosforylacji, funkcje i inhibitory
- 4966
- 927
- Estera Wojtkowiak
Fosforylacja oksydacyjna Jest to proces, w którym cząsteczki ATP są syntetyzowane z ADP i PSiema (Fosforan nieorganiczny). Mechanizm ten jest wykonywany przez bakterie i komórki eukariotyczne. W komórkach eukariotycznych fosforylacja przeprowadza się w matrycy mitochondrialnej komórek niefotosyntetycznych.
Produkcja ATP jest kierowana przez przeniesienie elektronów z koenzymów NADH lub FADH2 zbyt2. Proces ten reprezentuje największą produkcję energii w komórce i pochodzi z degradacji węglowodanów i tłuszczów.
 Źródło: Robot8a [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]
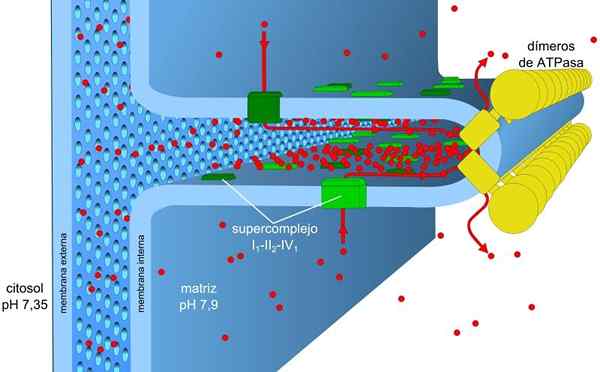
Źródło: Robot8a [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] Energia przechowywana w gradientach obciążenia i pH, znana również jako protoniczna siła motoryczna, pozwala na przeprowadzenie tego procesu. Generowany jest gradient protonu, powoduje, że zewnętrzna część membrany ma dodatnie obciążenie ze względu na stężenie protonów (h+), a matryca mitochondrialna jest ujemna.
[TOC]
Gdzie następuje fosforylacja oksydacyjna?
Procesy transportu elektronów i utleniające procesy fosforylacji są związane z błoną. W prokariotach mechanizmy te są przeprowadzane przez błonę plazmatyczną. W komórkach eukariotycznych są one związane z błoną mitochondriów.
Liczba mitochondriów znalezionych w komórkach zmienia się w zależności od typu komórki. Na przykład u ssaków erytrocyty nie mają tych organelli, podczas gdy inne typy komórek, takie jak komórki mięśniowe, mogą mieć miliony.
Membrana mitochondrialna składa się z prostej błony zewnętrznej, nieco bardziej złożonej membrany wewnętrznej, a pośrodku przestrzeni międzybranowej, w której znajduje się wiele enzymów zależnych od ATP.
Membrana zewnętrzna zawiera białko zwane porina, które tworzy kanały dla prostej dyfuzji małych cząsteczek. Ta membrana jest odpowiedzialna za utrzymanie struktury i kształtu mitochondriów.
Membrana wewnętrzna ma większą gęstość i jest bogata w białko. Jest również wodoodporny dla cząsteczek i jonów.
W macierzy rozciągają się fałdy membrany wewnętrznej, tworząc grzbiety, które pozwalają jej mieć duży obszar w małej objętości.
Energia komórkowa centralna
Mitochondria jest uważane za komórkowe centrum energii. Są w nim enzymy biorące udział w procesach cyklu kwasu cytrynowego, utlenianie kwasów tłuszczowych i enzymów redoks oraz białka transportu elektronów i fosforylacji PhD.
Gradient stężenia protonów (gradient pH) i gradient obciążeń lub potencjał elektryczny w błonie wewnętrznej mitochondriów, są przyczyną siły motorycznej protonicznej. Niewielka przepuszczalność błony wewnętrznej dla jonów (inne niż H+) umożliwia mitochondria na stabilny gradient napięcia.
Transport elektroniczny, protony pompujące i uzyskiwania ATP jednocześnie w mitochondriach, dzięki protonicznej sile motorycznej. Gradient pH utrzymuje warunki kwaśne w matrycy międzymłonkowej i mitochondrialnej w warunkach alkalicznych.
Na każde dwa elektrony przeniesione do O2 Około 10 protonów jest pompowanych przez membranę, tworząc gradient elektrochemiczny. Energia odłączona w tym procesie jest wytwarzana stopniowo przez przepuszczanie elektronów przez łańcuch przenośnika.
Gradacja
Energia uwalniana podczas reakcji ograniczających tlenek NADH i FADH2 Jest znacznie wysoki (około 53 kcal/mol dla każdej pary elektronów), więc należy stosować do produkcji cząsteczek ATP, należy je stopniowo wytwarzać z przejściem elektronów przez transportery.
Są one zorganizowane w czterech kompleksach znajdujących się w wewnętrznej błonie mitochondrialnej. Łączenie tych reakcji na syntezę ATP odbywa się w piątym kompleksie.
Może ci służyć: b limfocyty: charakterystyka, struktura, funkcje, typyŁańcuch transportu elektronów
NADH przenosi kilka elektronów, które wchodzą do kompleksu I łańcucha transportu elektronów. Elektrony są przenoszone do mononukleotydu flawiny, a następnie do ubikwiinonu (koenzymu q) przez przenośnik żelaza. Proces ten uwalnia dużą ilość energii (16,6 kcal/mol).
Ubiquinona transportuje elektrony przez membranę do kompleksu III. W tym kompleksie elektrony przechodzą przez cytochromy B i C1 Dzięki transporterowi żelaza.
Z kompleksu III elektrony przechodzą do kompleksu IV (oksydaza cytochromu C), przeniesiona jedna przez cytochrom C (białko błony obwodowej). W kompleksie IV elektrony przechodzą przez parę jonów miedzi (cuDo2+), następnie do cytochromu CDo, Następnie do innej pary jonów miedzi (cuB2+) i od tego do cytochromu do3.
Wreszcie elektrony są przenoszone do O2 który jest ostatnim akceptorem i tworzy cząsteczkę wody (h2O) dla każdej otrzymanej pary elektronów. Przejście elektronów od kompleksu IV do O2 Generuje również dużo swobodnej energii (25,8 kcal/mol).
Reduktaza COQ Succynato
Kompleks II (bursztynian reduktazy COQ) otrzymuje parę elektronów z cyklu kwasu cytrynowego, z powodu utleniania cząsteczki bursztynianowej do fumaranu. Te elektrony są przenoszone na modę, a następnie przechodząc przez grupę żelaza-azufre, do Ubiquinona. Z tego koenzymu idą do kompleksu III i podążają za opisaną wcześniej trasą.
Energia uwalniana w reakcji transferu elektronów na modę jest niewystarczająca, aby zwiększyć protony przez membranę, tak że na tym etapie łańcucha nie ma siły motorycznej, a w konsekwencji FADH daje mniej H+ niż NADH.
Sprzężenie energii lub transdukcja
Energia wytwarzana w wcześniej opisanym procesie transportu elektronów, powinna być stosowana do produkcji ATP, reakcji katalizowanej przez syntazę ATP lub złożony enzym V. Zachowanie takiej energii jest znane jako sprzężenie energii, a mechanizm był trudny do scharakteryzowania.
Opisano kilka hipotez opisujących tę transdukcję energii. Najlepiej zaakceptowany jest hipoteza sprzężenia chemosmotycznego, opisana poniżej.
Sprzężenie chemosmotyczne
Mechanizm ten sugeruje, że energia zastosowana do syntezy ATP pochodzi z protonicznego gradientu w błonach komórkowych. Proces ten interweniuje w mitochondriach, chloroplastach i bakteriach i jest powiązany z transportem elektronów.
Kompleksy I i IV elektronicznego transportu działają jako pompy protonowe. Cierpią na zmiany konformacyjne, które pozwalają im pompować protony do przestrzeni międzybranowej. W kompleksie IV dla każdej pary elektronów dwa protony są pompowane na zewnątrz membrany, a dwa kolejne pozostają w matrycy tworzących h2ALBO.
Ubiquinona w kompleksie III akceptuje protony kompleksów I i II i uwalnia je poza błoną. Kompleksy I i III pozwalają przejść czterech protonów dla każdej pary transportowanych elektronów.
Matryca mitochondriów ma niskie stężenie protonów i ujemnego potencjału elektrycznego, podczas gdy przestrzeń międzybranowa przedstawia warunki odwrotne. Przepływ protonów przez tę błonę implikuje gradient elektrochemiczny, który przechowuje niezbędną energię (± 5 kcal/mol przez proton) do syntezy ATP.
Synteza ATP
Enzym syntazy ATP jest piątym kompleksem zaangażowanym w fosforylację oksydacyjną. Jest odpowiedzialny za wykorzystanie energii gradientu elektrochemicznego w celu utworzenia ATP.
To transmembraalne białko składa się z dwóch składników: F0 i f1. Komponent f0 umożliwia powrót protonów do macierzy mitochondrialnej funkcjonującej jako kanał i f1 katalizuje syntezę ATP przez ADP i PSiema, Wykorzystanie energii wspomnianego powrotu.
Może ci służyć: białka przenośnika błony: funkcje i typyProces syntezy ATP wymaga zmiany strukturalnej w F1 i montaż komponentów f0 i f1. Translokacja protonów przez F0 Powoduje zmiany konformacyjne w trzech podjednostkach F1, pozwalając na działanie jako silnik rotacyjny, kierując tworzeniem ATP.
Podjednostka odpowiedzialna za związek ADP z PSiema przechodzi ze stanu słabego (L) do aktywnego (t). Po utworzeniu ATP druga podjednostka przechodzi do stanu otwartego (O), który umożliwia uwalnianie tej cząsteczki. Po zwolnieniu ATP podjednostka ta przechodzi ze stanu otwartego do stanu nieaktywnego (L).
Cząsteczki ADP i PSiema Dołączają do podjednostki, która wyszła z państwa lub stanu L.
Produkty
Łańcuch przenośnika elektronów i fosforylacja wytwarzają cząsteczki ATP. Utlenianie NADH wytwarza około 52,12 kcal/mol (218 kJ/mol) energii swobodnej.
Globalna reakcja na utlenianie NADH wynosi:
NADH+1⁄2 lub2 +H+ ↔ h2O+nad+
Przeniesienie elektronów z NADH i FADH2 Występuje przez kilka kompleksów, umożliwiając podzielanie zmiany energii swobodnej GG ° na mniejsze „pakiety”, które są sprzężone z syntezą ATP.
Utlenianie cząsteczki NADH generuje syntezę trzech cząsteczek ATP. Podczas gdy utlenianie cząsteczki FADH2 Jest dołączony do syntezy dwóch ATP.
Te koenzymy pochodzą z procesów glikolizy i cyklu kwasu cytrynowego. Dla każdej zdegradowanej cząsteczki glukozy kończy się 36 lub 38 ATP, w zależności od lokalizacji komórek. W mózgu i mięśniach szkieletowych 36 ATP są wytwarzane, a 38 ATP są wytwarzane w tkance mięśniowej.
Funkcje
Wszystkie organizmy, jednokomórkowe i wielokomórkowe, potrzebują minimalnej energii w swoich komórkach, aby wykonywać w nich procesy, a z kolei utrzymują funkcje życiowe w pełnym ciele.
Procesy metaboliczne wymagają przeprowadzenia energii. Większość energii użytecznej jest uzyskiwana przez degradację węglowodanów i tłuszczów. Ta energia wywodzi się z utleniającego procesu fosforylacji.
Kontrola fosforylacji oksydacyjnej
Szybkość stosowania ATP w komórkach, kontroluje syntezę tego samego, a z kolei ze względu na sprzężenie fosforylacji oksydacyjnej z łańcuchem transportu elektronów, ogólnie reguluje również prędkość transportu elektronicznego.
Fosforylacja oksydacyjna ma ścisłą kontrolę, która zapewnia, że ATP nie jest generowane szybciej niż jest zużyte. Istnieją pewne kroki w procesie transportu elektronów i sprzężonej fosforylacji, które regulują szybkość produkcji energii.
Skoordynowana kontrola produkcji ATP
Głównymi drógami produkcji energii (komórki ATP) są glikoliza, cykl kwasu cytrynowego i fosforylacja oksydacyjna. Skoordynowana kontrola tych trzech procesów reguluje syntezę ATP.
Kontrola fosforylacji przez stosunek działania masy ATP zależy od precyzyjnego udziału elektronów w łańcuchu przenośnym. To z kolei zależy od związku [NADH]/[NAD+], który jest zachowany podwyższony przez działanie glikolizy i cyklu kwasu cytrynowego.
Ta skoordynowana kontrola przeprowadza się przez regulację punktów kontrolnych glikolizy (cytrynian hamowany PFK) i cykl kwasu cytrynowego (pirogronian dehydrogenazy, cytrynian kroi, dehydrogenaza Itchitran i dehydrogenazy α-zetoglutaranu).
Kontrola przez akceptora
Kompleks IV (oksydaza cytochromu C) jest enzymem regulowanym przez jeden z jego substratów, to znaczy jego aktywność jest kontrolowana przez zmniejszony cytochrom C (C2+), co z kolei jest równoważone z relacją stężeń między [NADH]/[NAD+] i współczynnik działania masowego [ATP]/[ADP] + [PSiema].
Może ci służyć: ton: cechy i funkcjeIm wyższy [NADH]/[NAD+] i opuść [ATP]/[ADP]+[PSiema], większe stężenie będzie cytochromem [C2+] i większa będzie aktywność kompleksu IV. Jest to interpretowane na przykład, jeśli porównujemy organizmy z różnymi czynnościami spoczynkowymi i wysoką aktywnością.
U osoby o wysokiej aktywności fizycznej zużycie ATP, a zatem jej hydrolizę do ADP + PSiema Będzie bardzo wysoki, generując różnicę w stosunku działania, który powoduje wzrost [C2+a zatem wzrost syntezy ATP. W spoczynku występuje odwrotna sytuacja.
Ostatecznie prędkość fosforylacji oksydacyjnej wzrasta wraz ze stężeniem ADP w mitochondriach. Stężenie to zależy od translokatorów ADP-ATP odpowiedzialnych za transport nukleotydów adeniny i PSiema Od cytosolu do matrycy mitochondrialnej.
Agenci dekakoplanta
Na fosforylację oksydacyjną wpływają niektóre środki chemiczne, które umożliwiają kontynuowanie transportu elektronicznego bez fosforylacji ADP, oddzielenie produkcji i ochrony energii.
Środki te stymulują prędkość zużycia tlenu w mitochondriach przy braku ADP, powodując również wzrost hydrolizy ATP. Działają, eliminując pośrednik lub łamanie stanu energii z łańcucha przenośnika elektronów.
2,4-dinitrofenol, słaby kwas, który przechodzi przez błony mitochondrialne, jest odpowiedzialny za rozproszenie gradientu protonów, ponieważ łączą je po kwaśnej stronie i uwalniają je po podstawowej stronie.
Związek ten zastosowano jako „pigułki odchudzające”, ponieważ stwierdzono, że spowodował wzrost oddychania, a zatem wzrost szybkości metabolizmu i związanej z nimi utraty masy ciała. Wykazano jednak, że jego negatywny efekt może nawet spowodować śmierć.
Rozproszenie gradientu protonicznego wytwarza ciepło. Brązowe komórki tkanki tłuszczowej wykorzystują oddzielanie, kontrolowane hormonalnie, aby wytwarzać ciepło. Hibernacja ssaków i noworodków, które nie mają włosów, składają się z tej tkanki, która serwuje im jako rodzaj koca termicznego.
Inhibitory
Związki lub środki hamujące zapobiegają zarówno spożyciu lub2 (transport elektroniczny), takie jak powiązana fosforylacja oksydacyjna. Agenci te unikają tworzenia ATP poprzez zastosowanie energii wytwarzanej w transporcie elektronicznym. Dlatego łańcuch transportowy zatrzymuje się, ponieważ takie zużycie energii nie jest ułożone.
Antybiotyk oligomiciny działa jako inhibitor fosforylacji w wielu bakteriach, zapobiegając stymulacji ADP z syntezą ATP.
Istnieją również środki jonoforystyczne, które tworzą kompleksy rozpuszczalne w tłuszczu z kationami takimi jak k+ i na+, i przejdź przez błonę mitochondrialną z tymi kationami. Mitochondria następnie wykorzystuje energię wytwarzaną w transporcie elektronicznym do pompowania kationów zamiast syntetyzowania ATP.
Bibliografia
- Alberts, ur., Bray, d., Hopkin, k., Johnson, a., Lewis, J., Raff, m., Roberts, k. & Walter, p. (2004). Niezbędna biologia komórki. Nowy Jork: Garland Science.
- Cooper, g. M., Hausman, r. I. & Wright, n. (2010). Komórka. (PP. 397-402). Marbán.
- Devlin, t. M. (1992). Podręcznik biochemii: z korelacjami klinicznymi. John Wiley & Sons, Inc.
- Garrett, r. H., I Grisham, C. M. (2008). Biochemia. Thomson Brooks/Cole.
- Lodish, h., Darnell, J. I., Berk, a., Kaiser, c. DO., Krieger, m., Scott, m. P., & Matsudaira, p. (2008). Biologia komórek mięśniowych. Macmillan.
- Nelson, zm. L., & Cox, m. M. (2006). Zasady biochemii lehninger Wydanie 4. Ed Omega. Barcelona.
- Voet, d., & Voet, J. G. (2006). Biochemia. Wyd. Pan -american Medical.
- « Charakterystyka euglenophyta, reprodukcja, odżywianie, klasyfikacja
- Szkolenie glukozydy, funkcje i typy/grupy »

