Etapy glikogenolizy, miejsce docelowe glukozy, regulacja, choroby
- 2070
- 50
- Filip Augustyn
glukogeneliza Jest to proces lizy lub pęknięcie glikogenu. Jest to enzymatyczna ścieżka typu katabolicznego (zniszczenie), która implikuje degradację glikogenu i wyzwolenie glukozy-6-fosforanu.
Glikogen jest substancją stosowaną jako rezerwat glukozy. Występuje w cytoplazmie komórek i jest szczególnie obfity w wątrobie i komórkach mięśni zwierząt.

Jest to cząsteczka, którą niektórzy autorzy definiują jako „drzewo glukozy”, ponieważ ma ona rozgałęzioną strukturę. Jest to homopolimer złożony z powtarzanych jednostek odpadów glukozowych, które wiążą się ze sobą poprzez powiązania α-1,4 i α-1,6.
Gdy potrzebna jest glukoza, można to uzyskać z kilku źródeł: przez glukogenezę, glukozy krążącej we krwi lub mechanizmach produkcji glukozy za pomocą substancji nieglukozydowych. Ten ostatni mechanizm nazywa się glukoneogenezą i występuje głównie w wątrobie i nerce.
[TOC]
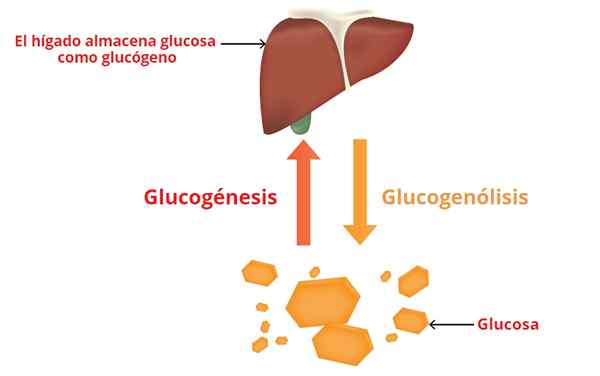
Gdzie to przychodzi i gdzie skierowana jest glukoza?
- Glukoza we krwi pochodzi z układu trawiennego i prawie wyłącznych procesów wkładu wątroby.
- Kiedy glikogenoliza występuje w mięśniach, wyzwolona glukoza wchodzi do procesów metabolicznych, które są zamierzone przez produkcję ATP (energia komórkowa).
- W wątrobie glukoza z glukogenolizy przechodzi do krwi, jednocześnie powodując wzrost glukozy we krwi (stężenie glukozy we krwi).
Etapy glikogenolizy
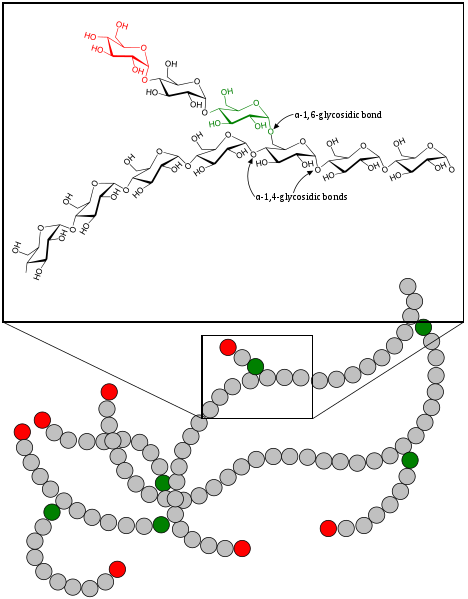 Schemat segmentu cząsteczki glikogenu, w którym pokazano dwa typy linków glikozydowych (Alfa 1.4 i Alfa 1.6) (Źródło: GKFXTALK 12:08, 5 września 2017 r. (UTC) / domena publiczna, przez Wikimedia Commons)
Schemat segmentu cząsteczki glikogenu, w którym pokazano dwa typy linków glikozydowych (Alfa 1.4 i Alfa 1.6) (Źródło: GKFXTALK 12:08, 5 września 2017 r. (UTC) / domena publiczna, przez Wikimedia Commons) Glikogenoliza jest procesem, którego nie można uznać za odwrotność syntezy glikogenu lub glukogenezy, jest inną ścieżką.
Faza 1: Wyzwolenie 1-fosforanu odpadów glukozy
Degradacja glikogenu zaczyna się od działania specyficznego enzymu zwanego glikogenem fosforylazy, który jest odpowiedzialny za „łamanie” wiązań α-1,4 glikogenu, uwalniania 1-fosforan glukozy. Mechanizm podzielony to fosforoliza.
Może ci służyć: Trójkąt Scarpa: granice, treść, znaczenieDzięki temu enzymowi strata glikozydowa najbardziej zewnętrznych łańcuchów glikogenu jest podzielona, dopóki po każdej stronie każdej gałęzi pojawią się około czterech pozostałości glukozy.
W glikogenu cząsteczki glukozy są połączone wiązaniami α-1,4, ale w miejscach rozgałęzionych linki są typu α-1,6.
Faza 2: Eliminacja konsekwencji
Gdy cztery reszty glukozy blisko punktów gałęzi, enzym, przenoszenie glukanu α-1,4 → α-1,4, przenosi jednostkę trisacharydową z jednej gałęzi, pozostawiając odsłonięcie punktu rozgałęzienia 1 → 6.
Enzym Unramping, w szczególności amyle 1 → 6 glukozydaza, hydrolizuje wiązania α-1,6. W ten sposób, ze względu na sekwencyjne działanie tych trzech enzymów (fosforylaza, transferaza glukanu i enzymu nienarodowa), występuje całkowity podział glikogenu.
1-fosforanowa glukoza z glikogenu przekształca się w glukozę 6-fosforanową poprzez odwracalną reakcję katalizowaną przez fosfoglukumutazę. W tej reakcji fosforan węglowy 1 jest „wycofany” do węgla 6 z powodu tego enzymu i tak kończy się glukogeneliza.
Miejsce docelowe glukozy
W wątrobie znajduje się enzym zwany 6-fosfatazą glukozy, która usuwa fosforan węgla glikozy i sprawia, że jest to „wolna” glukoza, która jest transportowana przez ściany komórkowe i przechodzi do krwi.
Mięsień nie może przyczynić się do glukozy do torrentu krążenia, ponieważ nie ma takiego enzymu, a fosforylowana glukoza jest „uwięziona” w komórkach mięśniowych.
6-fosforan glukozy w mięśniu wchodzi glikoliza, proces kataboliczny przeznaczony do produkcji ATP (tryfosforan adenozyny), szczególnie ważny podczas beztlenowego skurczu mięśni.
Rozporządzenie
Metabolizm glikogenu jest regulowany przez równowagę aktywności dwóch enzymów; taki, który jest używany do syntezy, czyli glikogenu-scetaza, a drugi, który jest używany do podziału, czyli glikogen-fosforylazę.
Równowaga aktywności tych enzymów stymuluje syntezę lub degradację glikogenu. Mechanizmy regulacji są podawane przez podłoża i przez złożony układ hormonalny, który obejmuje co najmniej cztery hormony: co najmniej cztery hormony:
Może ci służyć: kwadrat lędźwiowy: pochodzenie, wstawienie, funkcje, zaburzenia- Adrenalina
- Noreprenalina
- glukagon i
- insulina
- Regulacja glukogenolizy w wątrobie
 Wątroba (źródło: oryginalny przesyłanie był flonight w angielskiej Wikipedii.Wersje ly zostały przesłane przez Solarcaine w IN.Wikipedia. / Domena publiczna, przez wikimedia Commons)
Wątroba (źródło: oryginalny przesyłanie był flonight w angielskiej Wikipedii.Wersje ly zostały przesłane przez Solarcaine w IN.Wikipedia. / Domena publiczna, przez wikimedia Commons) Hormony mogą działać przez drugiego posłańca, który może być AMPC lub jony wapnia.
AMPC aktywuje glikogen-fosforylazę, a jednocześnie nieaktywne do-glikogenu. Z tego powodu katabolizm wzrasta i zmniejsza lub hamuje syntezę glikogenu (anabolizm).
Adrenalina i noradrenalina
Adrenalina i noradrenalina, działające przez receptory β-adrenergiczne i glukagon, działając przez specyficzne receptory, zwiększa poziomy AMPC w komórkach wątroby. Ten wzrost AMPC aktywuje glikogen-fosforylazę i rozpoczyna się katabolizm glikogenu.
Adrenalina i noreparanalina stymulują również glukogenoliza przez niezależny mechanizm AMPC i poprzez receptory α1-adrenergiczne. Ten mechanizm stymuluje mobilizację wapnia z mitochondriów.
Insulina
Insulina zwiększa aktywność enzymu zwanego fosfodiesterazą, odpowiedzialną za zniszczenie AMPC. W wyniku wpływu insuliny na wątrobę poziomy AMPC zmniejszają.
Równowaga tej aktywności hormonalnej jest tym, który określa „kierunek” metabolizmu glikogenu.
- Regulacja glikogenolizy w mięśniach
 Mięsień (Źródło: Stiller Beobachter z Ansbach, Niemcy/CC przez (https: // creativeCommons.Org/licencje/według/2.0) Via Wikimedia Commons)
Mięsień (Źródło: Stiller Beobachter z Ansbach, Niemcy/CC przez (https: // creativeCommons.Org/licencje/według/2.0) Via Wikimedia Commons) Glikogenoliza w mięśniu wzrasta natychmiast po rozpoczęciu skurczu mięśni. Wapń jest pośrednikiem, który synchronizuje aktywację fosforylazy z skurczem.
Wapń aktywuje fosforylazę Quinasa, która z kolei aktywuje mięśnie glikogen-fosforylazę lub miofosforylazę, ten enzym różni się od tej występującej w wątrobie, ale ma tę samą funkcję.
Insulina zwiększa poziom glukozy 6-fosforanu w komórkach mięśniowych, promując wejście glukozy z krążenia potoku. Poprzez zwiększenie 6-fosforanu glukozy, stymulowana jest leśniowa glikogen-sintetaza.
Może ci służyć: mięsakRezultatem netto jest wzrost glikogenezy mięśniowej i zmniejszenie lub hamowanie glikogenolizy.
Choroby związane z przechowywaniem glikogenu
Dziedziczna niewydolność niektórych specyficznych enzymów niezbędnych do wątroby i metabolizmu mięśni glikogenu jest jedną z przyczyn chorób magazynowania glikogenu.
Choroby te są nazwane razem jako glikogeneza. W zależności od obecnej winy enzymatycznej, są one wymienione według rodzajów I do VIII i są dodawane do tego, że zostały odkryte.
Niektóre glikogeneza są śmiertelne na bardzo wczesnych etapach życia, a następnie niektóre przykłady.
Niepowodzenia enzymatyczne obecne w glukogenozie generują nadmierne gromadzenie glikogenu, głównie w wątrobie, mięśniach i/lub nerkach. Istnieje jednak glikogeneza, która powoduje ten wpływ na erytrocyty lub lizosomy.
Choroba von Gierke
Glikogenezę typu I nazywa się chorobą von Gierke i towarzyszy jej 6-fosfataza niewydolność glukozy, która zwiększa obciążenie glikogenu w hepatocytach i nerkowych komórkach kanalikowych. Pacjent ma hipoglikemię, ketozę, laktacydemię i hiperlipidemię.
Choroba McARDLE
W chorobie Mcardle typu V istnieje deficyt glikogenny glikogennej mięśni, co przekłada się na niepowodzenie glukogenolizy mięśniowej. W konsekwencji istnieje niewielka tolerancja ćwiczeń, niski poziom mleczanu we krwi po wysiłku i bardzo wysoki poziom glikogenu w komórkach mięśniowych.
Jej choroba
W glikogenezie typu VI lub jej chorobie deficyt jest enzymem wątroby glikogenu-fosforylazy. W takich przypadkach występuje wzrost glikogenu wątroby z tendencją do hipoglikemii.
Bibliografia
- Biały, a., I Blanco, G. (2017). Rozdział 14 Metabolizm węglowodanów. Biochemia medyczna; Biały, a., White, g., Eds, 283-323.
- Ha, c. I., & Bhagavan, n. V. (2011). Podstawy biochemii medycznej: w przypadkach klinicznych. Academic Press.
- Jones, K. M. (1990). Biochemia: J. J. David Rawn, Neil Patterson Publications, (1105 stron) ISBN 0 89278 405 9.
- Murray, r. K., Granner, zm. K., Mayes, str. DO., & Rodwell, V. W. (2014). Ilustrowana biochemia Harpera. McGraw-Hill.
- MA Walls-Flores, Mohiuddin SS. Biochemia, glikogenoliza. [Zaktualizowano 24 lutego 20 lutego]. W: StatPearls [Internet]. Treasure Island (FL): Publishing StatPearls; 2020 Jan-. Dostępne w: NCBI.NLM.Nih.Gov

