Charakterystyka globiny, struktura, funkcja i zmiany
- 2434
- 686
- Pani Gilbert Stolarczyk
Globin Jest to struktura natury białkowej ułożona w formie sferycznej lub kulistych, ponieważ jego nazwa pochodzi. Ta struktura jest typu trzeciorzędowego i charakteryzuje się złożoną, ponieważ łańcuch aminokwasowy składa się z sferoproteiny. Istnieje kilka rodzajów łańcuchów globinowych, które zostały sklasyfikowane w greckich literach: Alfa, Beta, Delta, Gamma, Epsilon i Zeta.
Aminokwasy, które tworzą podstawową strukturę białka, różnią się w zależności od gatunku, do którego należą (ludzie lub zwierzęta). Istnieją również różnice w tym samym gatunku zgodnie z obecnym stanem życia organizmu (życie embrionalne, życie płodowe lub po urodzeniu).
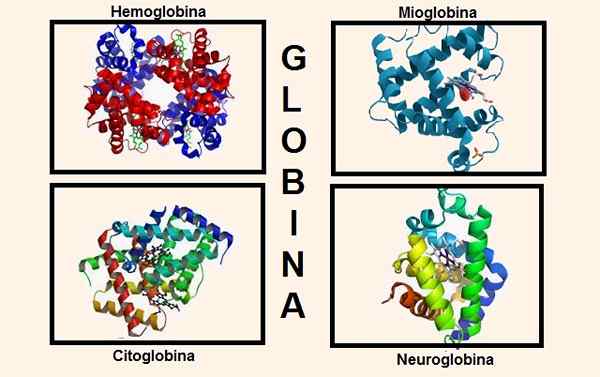
 Różne struktury zawierające globinę w swojej kompozycji. Źródła: Wikipedia.COM/Biancadescals [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]/Oryginalnym przesyłaniem był białexBot na angielskiej Wikipedii. [Domena publiczna]/Wikipedia.com
Różne struktury zawierające globinę w swojej kompozycji. Źródła: Wikipedia.COM/Biancadescals [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]/Oryginalnym przesyłaniem był białexBot na angielskiej Wikipedii. [Domena publiczna]/Wikipedia.com Informacje genetyczne do syntezy różnych łańcuchów globinowych są zawarte w różnych chromosomach. Na przykład globiny łańcucha alfa znajdują się na chromosomie 16, podczas gdy informacje genetyczne beta, delty, gamma i epsilon są na chromosomie 11.
[TOC]
Charakterystyka
Globina jest częścią ważnych struktur w ciele, na przykład najbardziej odpowiednie są: hemoglobina i mioglobina.
Hemoglobina zawiera cztery łańcuchy globinowe (Alfa 1 i Alfa 2) i (beta 1 i beta 2). Każda globin ma replikację, w której chroni grupę HEMO.
Z drugiej strony jest mioglobina. Który ma mniej złożoną strukturę niż hemoglobina. To przedstawia pojedynczy globalny polipeptyd ułożony wtórnie.
Do niedawna uważano, że były to jedyne substancje zawierające globinę w wyższych istotach, ale dziś dwie kolejne są znane, które mają globinę w swojej konstytucji: cytoglobina i neuroglobina.
Cytoglobina jest obecna w większości tkanek i jest szczególnie zlokalizowana w tkance łącznej, a także znaleziono w siatkówce.
Z kolei neuroglobina preferuje tkankę nerwową, stąd jej nazwa. Neuroglobinę znaleziono w komórkach nerwu mózgu zlokalizowanych na poziomie kory mózgowej, a także w innych lokalizacjach, takich jak wzgórze, podwzgórze, hipokamp i móżdżek.
Może ci służyć: taksonomia linnean żywych istotJednak nie są to jedyne lokalizacje, ponieważ poza układem nerwowym można je znaleźć w wysepkach Langerhansa w trzustce i siatkówce.
Struktura
Istnieje 6 różnych rodzajów łańcuchów globinowych, które są oznaczone literami greckiego alfabetu: alfa (α), beta (β), gamma (γ), delta (δ), epsilon (ε) i zeta (ζ). Łańcuchy te należą do rodziny globin, ale różnią się od siebie w liczbie posiadanych aminokwasów.
Te polipeptydy mają strukturę pierwotną, wtórną i trzeciorzędową. Prosty łańcuch aminokwasowy reprezentuje podstawową strukturę. Gdy łańcuch jest zwijany przez tworzenie spirali lub śmigierzy tworzą strukturę wtórną.
Jeśli ta struktura to składa się wiele razy na sobie, tworzy strukturę kulistą odpowiadającą strukturze trzeciorzędowej.
Podobnie, mogą one zdobyć czwartorzędowy kształt tylko wtedy, gdy 4 cząsteczki lub łańcuchy globiny są połączone w postaci trzeciorzędowej.
Jest to przedstawione w złożonej strukturze hemoglobiny. Jednak w mioglobinie jest inaczej. W tym przypadku globina jest prezentowana jako monomer, to znaczy ma pojedynczy łańcuch peptydowy ułożony w fałdach, tworząc 8 śmigła (struktura wtórna).
Zarówno hemoglobina, jak i mioglobina mają grupę hemo w ich złożonej strukturze.
Hemoglobina
W tej cząsteczce łączy się 2 łańcuchy globinów alfa i 2 łańcuchy beta. W ten sposób są one idealnie sprzężone, aby umieścić grupę Hemo w jej środku, a także żelazo.
Wśród tych struktur są słabe związki i silne związki. W słabych związkach uczestniczy 19 aminokwasów, a związek występuje w następujący sposób: łańcuch Alfa 1 dołącza do łańcucha beta 2, a łańcuch Alfa 2 łączy się z łańcuchem beta 1.
Podczas gdy 35 aminokwasów i łączące łańcuchy to: łańcuch Alfa 1 łączy łańcuch beta 1, a łańcuch Alfa 2 łączy łańcuch beta 2.
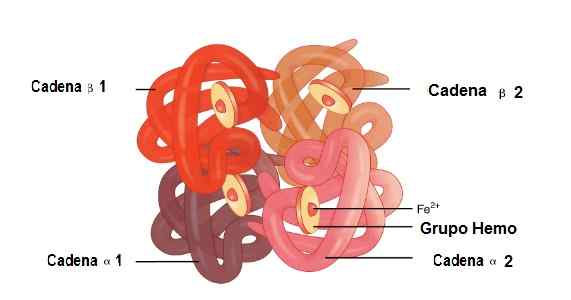 Lokalizacja łańcuchów Alfa 1 i Alfa 2, Beta 1 i beta 2 w strukturze hemoglobiny. Źródło: Openx College [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Edytowany obraz (przetłumaczony na hiszpański)
Lokalizacja łańcuchów Alfa 1 i Alfa 2, Beta 1 i beta 2 w strukturze hemoglobiny. Źródło: Openx College [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)] Edytowany obraz (przetłumaczony na hiszpański) Myoglobina
W mioglobinie występuje również grupa białek kulistych, ale w tym przypadku istnieje pojedynczy łańcuch peptydowy składający się z 153 aminokwasów. Jego przestrzenne usposobienie jest wtórne i przedstawia 8 śmigieł alfa.
Może ci służyć: oligoementy: po co one są, po co oniTa struktura białka strategicznie umieszcza hydrofobowe aminokwasy w strukturę, podczas gdy hydrofilowe lub polarne aminokwasy są na zewnątrz.
Ten projekt jest idealny do pomieści grupy HEMO w środku (część hydrofobowa). Wiąże się to z białkiem przez niezwiązane wiązania.
Cytoglobina
Został odkryty w 2001 roku i mówi się, że jest to rodzaj hemoglobiny, ale różni się tym, że jest heksakoordynowana, podczas gdy hemoglobina i mioglobina są Pentakoordynowane. Ma to związek z pozycją przyjętą przez aminokwas histydyny w pobliżu grupy hemo.
Neuroglobina
Jego odkrycie zostało dokonane w 2000 roku. Neuroglobina to monomer z 150 aminokwasami, dlatego jest bardzo podobny do mioglobiny. Struktura neuroglobiny ma podobieństwo między 21 a 25% z mioglobiną i hemoglobiną.
Funkcje
Ponieważ globina nie jest sama w ciele, ale będąc częścią niektórych struktur, wspomniane są funkcje, które każda z nich wypełniła:
Hemoglobina
Znajduje się w erytrocytach. Jest odpowiedzialny za naprawienie i transport tlenu z płuc do tkanek. A także korpus dwutlenku węgla, tworząc przeciwną drogę.
Myoglobina
Grupa HEMO zlokalizowana w globinie ma funkcję przechowywania cząsteczek tlenu w celu utleniania mięśni sercowych i mięśni szkieletowych.
Cytoglobina
Uważa się, że to białko wpływa na ochronę niedotlenienia i stresu oksydacyjnego w tkankach. Uważa się również, że tlen tętniczego może transportować do mózgu.
Neuroglobina
Uważa się, że neuroglobina ma zdolność do naprawy tlenu, tlenku mon tlenek węglowy i azotowy.
Jednak nie jest jeszcze znane z pewnością, jaka jest funkcja neuroglobiny, ale uważa się, że jest ona związana z regulacją niedotlenienia i niedokrwienia mózgu. Szczególnie działałby jako neuroprotektor.
Może ci służyć: teoria transformizmu LamarckPonieważ neuroglobina ma strukturę podobną do hemoglobiny i mioglobiny, spekuluje się, że może ona uczestniczyć w dostawie tlenu na poziomie neuronalnym. Uważa się również, że może wyeliminować wolne rodniki i azot występujący w łańcuchu oddechowym.
W odniesieniu do tlenku azotu uważa się, że wyeliminowanie go, gdy tlen jest normalny i wytwarza go w procesach niedotlenienia2.
Zmiany
Łańcuchy alfa i beta globiny są kodowane przez różne geny znajdujące się odpowiednio na chromosomach 16 i 11.
Osoby, które mają hemoglobinę (niedokrwistość falciform lub drapanocytowa) mają wadę w łańcuchu beta globiny. Wada składa się z zastąpienia zasad azotu na poziomie nukleotydu numer 20 genu, gdzie następuje zmiana adeniny przez timin.
Mutacje w genie βS chromosomu 11 pochodzi z różnych halopów Globinas o nazwie: Senegal, Kamerun, Benín, Bantú lub samochód oraz Azjat.
Znajomość rodzaju haplotypu przedstawionego przez pacjentów z niedokrwistością Falciform jest ważną epidemiologiczną, ponieważ pozwala poznać rozkład różnych haplotypów, ale także informacje te dostarczają ważnych danych, aby poznać rokowanie choroby.
Na przykład: Wiadomo, że halotyp Bantu jest poważniejszy, podczas gdy typ Senegal i azjatycki są łagodniejsze.
Różnice między haplotypem a innym leżą w ilości hemoglobiny F, którą posiadają. Wyższy odsetek hemoglobiny F i lepsze prognozy hemoglobiny. Mniej hemoglobiny F i więcej hemoglobiny.
Mutacje te są dziedziczone autosomalnie wraz z mutacją hemoglobiny.
Bibliografia
- „Globin." Wikipedia, bezpłatna encyklopedia. 19 października 2018, 13:44 UTC. 11 lipca 2019, 17:26, Wikipedia.org
- „Myoglobin." Wikipedia, bezpłatna encyklopedia. 7 lipca 2019, 21:16 UTC. 11 lipca 2019, 20:42, Wikipedia.org
- Durán C, Morales O, Echeverri S, Isaza M. Halotypy genów globiny beta u nosicieli hemoglobiny w Kolumbii. Biomedical 2012; 32: 103-111. Dostępne na: Scielo.org
- Forrellat M, Hernández P. Neuroglobin: nowy członek rodziny Globinas. Cuban Rev Immunol Hemother 2011; 27 (3): 291-296. Dostępne na: Scielo.Sld
- „Cytoglobina." Wikipedia, bezpłatna encyklopedia. 1 września 2017, 17:26 UTC. 12 lipca 2019, 00:28 Wikipedia.org
- « Charakterystyka heteropolisacharydów, struktura, funkcje
- Objawy, przyczyny i leczenie paranoiczne schizofrenii »

