Galwanoplastyka

- 3297
- 165
- Estera Wojtkowiak
Wyjaśniamy, z czego składa się galvanoplastyka, zwana także elektrodepozycją, w jaki sposób jego proces, praktyczne przykłady i zastosowania.
 Galwanoplastyka łyżki
Galwanoplastyka łyżki Co to jest galwanoplastyka?
Galwanoplastyka lub elektrodepozycja jest techniką elektrochemiczną, która składa się, jak sugeruje jego nazwa, w osadzaniu warstw metali na obiektach odbierających; To znaczy, pokrywając je z metalowej pokrywy, której grubość waha się między 5-20 μm.
Technika ta jest również znana jako elektrochapado lub elektrolityczna, jako środowisko elektrolityczne złożone z jonów metali metalu, który jest pożądany do osadzenia się jest niezbędny do jego wdrożenia. Dlatego jeśli chcemy miedzianej (miedzi), będziemy potrzebować soli rozpuszczalnych w miedzi, takich jak siarczan miedzi, rozpuszczony w wodzie.
Poprzednie rozumowanie dotyczy dowolnego innego metalu: złote elektrolityczny będzie wymagał złotych soli, zwykle złotych cyjanków, które mogą stać się bardzo toksyczne. Zatem niektóre obiekty, takie jak przybory jedzenia, można powlekać złotem, aby przypisać większą wartość i szlachetność.
Ale galwanoplastyka wykracza poza estetykę: są one przyznane. Umożliwia także oszczędzanie zasobów naturalnych, ponieważ nie jest konieczne wydawanie dużych ilości metalu na powłoki.
Proces galwanoplastyki
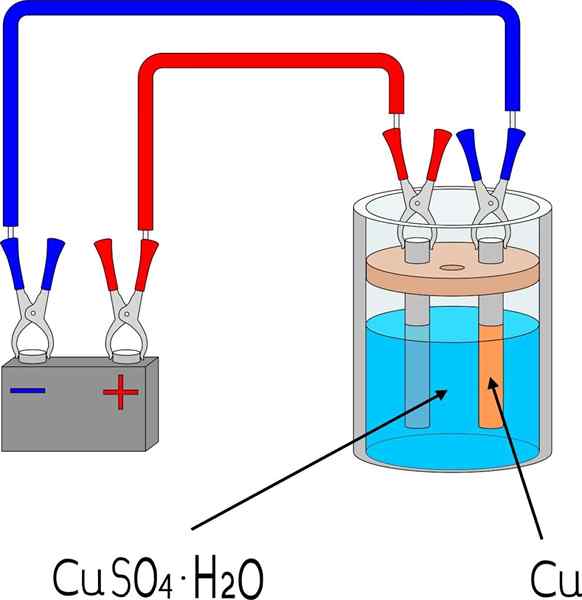 Elektrodepozy miedzi w łazience miedzianej siarczanowej
Elektrodepozy miedzi w łazience miedzianej siarczanowej Rzeczy
Aby elektrodeposować metal na powierzchni, potrzebne są pewne podstawowe elementy, których wymiary i tryb będą się różnić w zależności od partii obiektów, które należy przykryć.
Na przykład na górnym obrazie pokazano małą elektrodę miedzianą, powtarzalną w dowolnym laboratorium lub przestrzeni.
Medium elektrolityczne
Po pierwsze, potrzebny jest elektrolitowy środek metalu do elektrodepozy. Sól siarczanowa miedzi, cuo4, Jest bardzo rozpuszczalny w wodzie, więc przynosi jony cu2+ które następnie zostaną zredukowane do atomów Cu0. Te atomy to te, które zostaną zmontowane na powierzchni odbiorczej, aby zwiększyć kryształy metalowe.
Pożywka elektrolityczna jest niezbędna dla obwodu do pracy, a obciążenia jonowe mogą poruszać się lub mobilizować w kierunku regionu, w którym występuje elektropozycja.
Elektrody
Elektrody to powierzchnie, na których odbywa się elektrodkładka z jej podstawy chemicznej. Mówiąc prosto, istnieją dwie elektrody: katoda, w której metal jest elektrodepami; A anoda, w której zachodzi reakcja chemiczna, która przekazuje elektrony na jony metalowe, które pokrywają katodę.
Może ci służyć: uretan: struktura, właściwości, uzyskiwanie, użyciaOznacza to, że katoda staje się dziełem, który jest pożądany. Tymczasem anoda to każda powierzchnia, na której gatunek utlenia się i przekazuje swoje elektrony na katodę. Wiele razy anoda jest wykonana z tego samego metalu, który jest rozpuszczony w środowisku elektrolitycznym. Jeśli na środku występuje miedź, w tym przypadku anoda będzie metaliczną miedź.
Obwód zewnętrzny
Obwód zewnętrzny to akumulator, który zapewnia początkowe elektrony, które promują elektrodkładkę. Jego obecność oznacza, że reakcja nie jest spontaniczna: energia elektryczna jest potrzebna do wygenerowania zmiany chemicznej, która jest zmniejszeniem rozpuszczonych jonów metalu.
Czyszczenie elektrod
Kawałek, który należy przykryć, musi być całkowicie czysty. W przeciwnym razie plamowana lub powłoka będzie wadliwa.
Aby to zrobić, musisz upewnić się, że jej powierzchnia jest całkowicie hydrofilowa, to znaczy nie ma tłuszczu ani żadnego brudu. Jednym ze sposobów, aby zapewnić to, po przemyciu chemicznym, jest zwilżenie kawałka wodą, a jeśli zaobserwowano tworzenie kropli wody lub niejednorodne cieczy, oznacza to, że elektroda nie jest jeszcze czysta.
Reakcje i znaczenie elektronów
Galwanoplastyka jest reakcją redoks. Dlatego: jeden gatunek musi zostać zmniejszony, a drugi utleniony lub odwrotnie. W miedzi mamy anodę wykonaną z miedzi i katodę wykonaną z metalowego me (żelazo, cynk, puszka itp.).
Po włączeniu akumulatora przepłyną elektrony do katody, która zaczyna ładować negatywnie.
Negatywne obciążenie katody przyciąga kationy cu2+ środowiska elektrolitycznego, które ma miejsce w redukcji:
Cu2+(AC) +2E- → Cu (y)
Może ci służyć: reakcja MaillardAkumulator musi odzyskać podarowane elektrony, a także jony Cu należy odzyskać2+ zredukowane do utrzymania neutralności środowiska elektrolitycznego. Wtedy anoda występuje w funkcji: Atomy miedzi utleniają się:
Cu (y) → cu2+(AC) +2E-
A uwalniane elektrony są skierowane z powrotem do akumulatora, co z kolei mobilizuje je w kierunku katody, aby kontynuować elektropozycję.
Anoda zyskuje dodatnie obciążenie, co przyciąga jony SO42- pożywki elektrolitycznej (patrz obraz ponownie).
Oznacza to, że występują reakcje to redukcja i utlenianie miedzi, metalu, który jest elektrodepami:
Cu2+(AC) +2E- → Cu (y)
Cu (y) → cu2+(AC) +2E-
Anoda z miedzi tracą ciasto, podczas gdy katoda innego metalu jest pokryta drobną miedzianą warstwą.
Przykłady galwanoplastyki
Srebro
Metale mogą być „galwaniza. Jest to szczególnie korzystne w elementach elektronicznych, które muszą prowadzić energię elektryczną. Srebro może być elektrodepozytu na stali, miedzi, niklu i innych metalach.
Cynowany
Tinner to elektrodkładka cyny. Jest to bardzo przydatne w produkcji puszek żelaznych, które są pokryte cyną, aby były odporne na korozję, a zatem nie uszkadzają żywności lub produktów, które przechowują.
Łacińska lub opalenizna
Chociaż nieco bardziej skomplikowane, mosiądz i brąz mogą być również elektrodeposami na niektórych metalach, aby poprawić ich wygląd.
Zincado
Galwanoplastyka cynku lub cynku (nie myląca z termiczną ocynkowaną) jest najczęściej stosowana do przyznawania odporności żelaza na korozję i jaśniejsze i bardziej atrakcyjne powierzchnie. Zatem jego funkcja jest estetyczna i jednocześnie funkcjonalna, i znajduje się w częściach ciała, takich jak koła.
Metalowe tworzywa sztuczne
Tworzywa sztuczne, wcześniej traktowane jako powierzchnia przewodząca, można również przykryć metalem, co jest tak, jakby były przylegane do arkusza folii aluminiowej.
Może ci służyć: kolba kitasatoZastosowania galwanoplastyki
Zastosowania galwanoplastyki lub elektrodkładania można podzielić na funkcjonalne lub estetyczne.
Funkcjonalny
 Cienkie elektrody złota w widzach przypadków astronautów pozwala im chronić oczy przed światłem słonecznym
Cienkie elektrody złota w widzach przypadków astronautów pozwala im chronić oczy przed światłem słonecznym Powlekanie kawałka lub przedmiotu oznacza zapewnienie jego powierzchni właściwości, których sam brakuje. Na przykład elektrod miedzi lub złotych powoduje, że posiadane elementy są idealne w obwodach elektronicznych, aby skorzystać z właściwości tych metali, bez potrzeby wydawania ton złota na wytwarzanie całości i solidnych kawałków.
Z drugiej strony złoto chroni powierzchnie ciepła i promieniowania. Z tego powodu jest powszechnie używany w satelitach i hełmach astronautów, ponieważ odzwierciedla światło słoneczne, w ten sposób wprowadza ich oczy lub szybko gorąca.
Chrome lub nikłe stale są bardzo odporne na korozję, dokładnie dzięki tym metalowym warstwom. Właśnie dlatego galwanoplastyka jest stosowana w branży do ochrony metali wrażliwych na corrod.
Estetyka
Młodka metalowych licówek. Cynk, nikiel i chrom są bardzo używane w tym celu. Również złoto i srebro to elektrodepos w pierścieniach, łańcuchach, bransoletach, dławikach, stokach itp., I dlatego jego galwanoplastyka znajduje wiele zastosowań w sklepach i ozdobach biżuterii, aby poprawić wizerunek i prestiż tych odzieży.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2021). Galwanotechnika. Źródło: w:.Wikipedia.org
- Chris Woodford. (28 lipca 2020). Jak działa galwanizacja. Pobrano z: Expinthatstuff.com
- Rob Snyder. (S.F.). Nanoskal Elektrodepozycja. STEM Education Institute. [PDF]. Odzyskany z: nanoskal.Un.Edu
- Elsevier b.V. (2021). Elektrodepowanie. Scientedirect. Pobrano z: Scientedirect.com
- Vaishali Mittal. (10 grudnia 2020). Galwanotechnika. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Singh Davneet. (9 czerwca 2020). Różne rodzaje elektroplingu. Odzyskane od: Teachoo.com
- Helmestine, Anne Marie, pH.D. (26 sierpnia 2020). Co jest galwaniczne i jak to działa? Odzyskane z: Thoughtco.com

