Siły van der waals
- 739
- 37
- Arkady Sawicki
Wyjaśniamy, jakie Van der Waals są siłami, ich cechami, rodzajami i przykładami w każdym
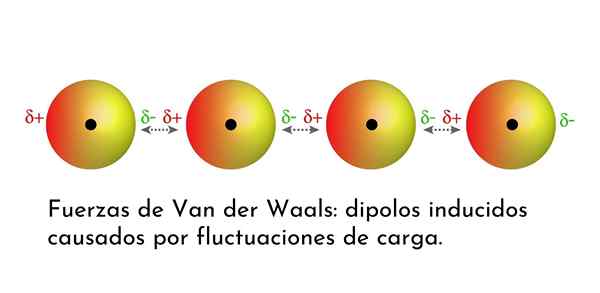
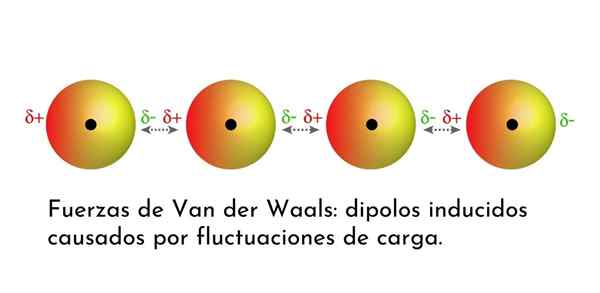 Ilustracja, która pokazuje jeden z rodzajów sił Van der Waalsa, londyńskie siły dyspersji, wśród kilku atomów z natychmiastowym dipolem
Ilustracja, która pokazuje jeden z rodzajów sił Van der Waalsa, londyńskie siły dyspersji, wśród kilku atomów z natychmiastowym dipolem Jakie są siły van der Waalsa?
Siły van der waals Są zestawem krótkich sił przyciągania między wszystkimi atomami i cząsteczkami. Otrzymują swoje imię na cześć holenderskiego naukowca Johannesa Diderik van der Waals.
Siły te są stosunkowo słabe, ale pojawiają się na całej powierzchni kontaktu między dwoma atomami, między dwiema cząsteczkami lub między dwiema powierzchniami, więc jeśli wspomniana powierzchnia kontaktu jest duża, siły van der Waalsa mogą stać się znaczne.
Zrozumienie sił Van der Waalsa pozwala jakościowo przewidzieć wiele fizycznych właściwości substancji chemicznych, takich jak ich temperatura topnienia i wrzenia oraz rozpuszczalność w różnych typach rozpuszczalników. Są to siły, które pozwalają wyjaśnić, w jaki sposób jest możliwe, że gaz monoatomiczny, taki jak hel, który nie tworzy żadnego rodzaju wiązania chemicznego, może skondensować i przenieść do stanu ciekłego.
Siły te wyjaśniają również, dlaczego substancja taka jak woda, która jest tworzona przez cząsteczki, których masa trzonowa wynosi zaledwie 18 g/mol, jest ciekła, a chlor, który waży prawie 4 razy więcej, jest gazem w temperaturze pokojowej.
Charakterystyka sił van der waals
Oprócz reprezentowania rodzaju siły przyciągania między atomami i cząsteczkami, siły van der Waalsa nie mają wielu cech z wiązaniami chemicznymi. Następnie przedstawiono najwybitniejsze cechy tego rodzaju sił:
- Są siłami zależnymi od odległości. W najprostszym przypadku zmniejszają się wraz z kwadratem odległości. Ponadto zależą one silnie od geometrii molekularnej.
- W porównaniu z siłami przyciągania, które występują w linkach jonowych, kowalencyjnych i metalicznych, siły van der Waalsa są stosunkowo słabe.
- Z wyjątkiem interakcji dipol-dipolo, są to niezależne interakcje temperaturowe.
- Są to krótkie siły, co oznacza, że szybko spadają, gdy atomy i cząsteczki odchodzą.
- Są to siły ogólne, które występują między dowolnym atomem a jakąkolwiek cząsteczką.
- W przeciwieństwie do kowalencyjnych więzi, nie mają one kierunkowości. Oznacza to, że niezależnie od orientacji, z którą zbliżają się dwie cząsteczki, jeśli zbliżają się wystarczająco, siły van der Waalsa zawsze będą się pojawiać.
- Gdy dwie cząsteczki lub atomy zbliżają się zbyt wiele, siła staje się odpychająca, co zapobiega obadu cząsteczek.
- Są one addytywne, co oznacza, że pomimo bycia znacznie słabego, istnienie wielu jednoczesnych interakcji może powodować znaczną siłę przyciągania.
Rodzaje sił Van der Waals
Oprócz składnika odpychającego, który zapewnia, że atomy i cząsteczki nie zapadają się, istnieją trzy rodzaje sił van der Waalsa, które mogą, ale nie muszą działać w tym samym czasie między dwiema cząsteczkami lub atomami. Są one przedstawione poniżej:
1. Interakcje Dipolo-Dipolo lub siły Keesom
Siła Keesoma jest jednym z podatników siły Van der Waalsa. Są to siły interakcji elektrostatycznych, które pojawiają się wśród stałych dipoli cząsteczek polarnych, takich jak woda, aceton i inne.
Siły Keesoma są podobne do sił elektrostatycznych między jonami, ale różnią się od tych, ponieważ są znacznie słabsze i rozkładają się z szóstą mocą odległości (to znaczy z r z r r6). Powodem, dla którego są słabsze, jest to, że przyciąganie występuje między częściowymi obciążeniami dipola, zamiast całych ładunków elektrycznych, jak w przypadku jonów.
Te interakcje są podawane tylko między cząsteczkami, a nie między atomami, ponieważ atomy nie mają trwałych momentów dipolowych. Ponadto siła Keesoma jest odwrotnie proporcjonalna do temperatury, co oznacza, że po wzroście siła Keesoma maleje.
Przykłady cząsteczek, które mają interakcje dipol-dipolo
Wszystkie cząsteczki polarne mają między nimi interakcje dipol-dipol. Na przykład:
- Dwie cząsteczki acetonowe.
- Dwie cząsteczki chloroformowe.
- Cząsteczka cykloheksanonu z cząsteczką acetonową.
2. Indukowane interakcje Dipolo-Dipolo lub siły debye
Gdy cząsteczka polarna zbliża się do atomu lub cząsteczki apolarnej, dipol pierwszego przyciąga lub powtarza elektrony na powierzchni drugiego. To indukuje dipol w cząsteczce apolarnej, która nazywa się indukowanym dipolem. Nowy dipol powstał, a następnie wchodzi w interakcje z oryginalnym dipole, tworząc niewielką siłę przyciągania.
Może ci służyć: ciepło spalaniaTe interakcje między dipolem stałym i indukowanym są zwykle znane jako siły debye i zależą nie tylko od odległości między dwiema cząsteczkami lub między cząsteczką polarną a indywidualnym atomem, ale również zależą od polaryzowalności cząsteczki apolarnej i wielkości wielkości momentu dipolowego cząsteczki polarnej.
Przykłady cząsteczek, które indukowały interakcje dipol-dipol
Tego rodzaju interakcje są podawane tylko między różnymi cząsteczkami, ponieważ jedno jest potrzebne do bycia polarnym, a drugi nie. Niektóre przykłady to:
- Atom szlachetnego gazu, takiego jak argon i związek polarny, taki jak chlorek wodoru. W tym przypadku dodatnie obciążenie częściowe w HCl wodór przyciąga elektrony argonu walencii, generując niewielki dipol indukowany w tym ostatnim. Jeśli argon zbliży się do atomu chloru, ujemne obciążenie częściowe odpłaci elektrony walencyjne i powstaje również indukowany dipol.
- Brominian molekularny (BR2) Jest znacznie rozpuszczalny w wodzie, pomimo tego, że jest to związek apolowy i woda silnie polarnego rozpuszczalnika. Wyjaśnienie wynika częściowo z wysokiej polaryzowalności bromu, która pozwala tworzyć znacznie silne interakcje.
3. Indukowane interakcje indukowane przez Dipolo-Dipolo lub londyńskie siły dyspersji
Ze wszystkich sił Van der Waalsa najsłabsze są siły dyspersji w Londynie. Te interakcje są podawane między wszystkimi atomami i cząsteczkami ze względu na pojawienie się natychmiastowych dipoli w dowolnej części ich struktury.
Natychmiastowy dipol to mały dipol, który jest utworzony przez asymetryczny rozkład elektronów walencyjnych w danym momencie.
Może ci służyć: nienasycone węglowodoryJak generowane są natychmiastowe dipole?
Ponieważ elektrony obracają się wokół jądra, może się zdarzyć, że kiedyś z jednej strony jest więcej elektronów niż z drugiej, co powoduje dipol. Ten mały dipol znika szybko, gdy elektrony nadal poruszają się po jądrze i dlatego nazywane są migawkami.
Natychmiastowe dipole mogą pojawić się w dowolnym miejscu w strukturze cząsteczki i w dowolnym momencie może być ich wiele. Londyńskie siły dyspersji składają się z interakcji między tymi chwilami w jednej cząsteczce i innej.
Przykłady związków, które mają londyńskie siły dyspersji
Jak wspomniano, te rodzaje interakcji występują między wszystkimi atomami i cząsteczkami. Jednak to w dużych cząsteczkach apolarnych można lepiej zaobserwować jego działanie, ponieważ w tych przypadkach jest to jedyny rodzaj interakcji międzycząsteczkowej, która występuje.
Typowym przykładem, w którym siły te są bardzo intensywne, jest w przypadku długiego łańcucha węglowodorów alifatycznych, szczególnie w polimerach, takich jak polietylen.

