Historia fosforu, właściwości, struktura, uzyskiwanie, zastosowania

- 1539
- 92
- Matylda Duda
On mecz Jest to element niemetaliczny, który jest reprezentowany przez symbol chemiczny P i ma atomowy numer 15. Przedstawia trzy główne formy alotropowe: biały, czerwony i czarny fosfor. Biały fosfor jest fosforescencyjny, płoną spontanicznie po wystawieniu na powietrze, a także jest wysoce trujący.
Biały fosfor w temperaturze 250 ° C staje się czerwonym fosforem; postać polimeryczna, nierozpuszczalna i to nie płoną w powietrzu. W wysokich temperaturach i ciśnieniach, a także w obecności lub nie katalizatorów, uzyskuje się czarny fosfor, który przypomina grafit i jest dobrym przewodnikiem energii elektrycznej.
 Biały fosfor przechowywany w butelce z wodą. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Biały fosfor przechowywany w butelce z wodą. Źródło: w. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Fosfor po raz pierwszy izolowano przez H. Marka, w 1669. Aby to zrobić, mocz używany jako źródło tego elementu. W 1770 r. W. Scheele odkrył, że może również izolować fosfor kości.
Następnie, ze względu na stworzenie piekarnika elektrycznego przez J. Burgess Readman (1800), skały fosforanowe stały się głównym źródłem produkcji fosforu z rudy fluoroapatytowej, obecnych w nich.
Fosfor to dwunastu bardziej obfity element skorupy ziemskiej i reprezentuje 0,1% z wagi. Ponadto jest to szósty element obfitości w ludzkim ciele; głównie skoncentrowane w kościach w postaci hydroksylapatytu.
Jest to zatem niezbędnym elementem żywych istot, stając się jednym z trzech głównych składników odżywczych roślin. Fosfor jest częścią chemicznej struktury kwasów nukleinowych; związków magazynowania energii (ATP), koenzymów; i ogólnie związki metabolizmu.
[TOC]
Historia
- Odkrycie
W moczu
 Joseph Wright z Derby Painting, w którym ilustruje fosfor odkrycie. Źródło: Joseph Wright z Derby [domena publiczna]
Joseph Wright z Derby Painting, w którym ilustruje fosfor odkrycie. Źródło: Joseph Wright z Derby [domena publiczna] Fosfor został wyizolowany przez Henning Brand w 1669 roku, będąc pierwszym człowiekiem, który izolująca element. Brand był niemieckim alchemikiem z Hamburga i udało mu się uzyskać związek fosforu z moczu. Aby to zrobić, zebrał mocz 50 wiader i pozwolił mu się rozłożyć.
Marka następnie odparowała mocz i uzyskała czarną pozostałość, która zachowała przez kilka miesięcy. Do tego dodanego piasku i rozgrzałem go, udając eliminować gazy i oleje. W końcu uzyskał białą substancję stałą, która lśniła w ciemności z zielonym kolorem, który nazwał „zimnym ogniem”.
Termin „fosfor”, przypadkowo pochodzi od greckiego słowa „fosfory”, co oznacza nosiciel światła.
Brand nie opublikował swoich eksperymentalnych wyników i sprzedała je kilku alchemikom, w tym: Johann Kraft, Kunckel Lowenstern i Wilhelm Leibniz. Prawdopodobnie niektórzy z nich zgłosili pracę marki Akademii Nauk o Paryżu, rozpowszechniając w ten sposób dochodzenie.
Jednak marka tak naprawdę nie izolowała fosforu, ale amoniakalny fosforan sodu [NH (NH (NH4) PO4]. W 1680 r. Robert Boyle ulepszył procedurę Brand, dzięki której mógł uzyskać wolną formę fosforu (str4).
W kościach
Johan Gottlieb Gahn i Carl Wihelm Scheele ustalili w 1769 r., Że związek fosforu, fosforan wapnia, był w kościach. Niezwłoczne kości poddano procesie trawienia silnymi kwasami, takimi jak kwas siarkowy.
Następnie produkt trawienia ogrzewano w stalowych pojemnikach z węglem i węglem, uzyskując w ten sposób biały fosfor przez destylację w retorty. Kości były głównym źródłem uzyskiwania fosforu do 1840 r., Kiedy to zostały zastąpione w tym celu Guano.
W guano
Guano to mieszanka ptaków ptaków i ich produktów rozkładu. Był używany jako źródło fosforu i nawozów w XIX wieku.
- Rozwój przemysłowy
Skały fosforanowe zostały wykorzystane w 1850 roku jako źródło fosforu. To, wraz z wynalezieniem piekarnika elektrycznego do kalcynacji skał Jamesa Burgesa Readmana (1888), sprawiło, że skały fosfatyczne jest głównym surowcem produkcji fosforu i nawozów.
W 1819 r. Ustanowiono fabryki Cerrillas, rozpoczynając rozwój przemysłowy fosforu.
Fizyczne i chemiczne właściwości
Wygląd
W zależności od postaci alotropowej może być bezbarwna, zamknięta biała, żółta, szkarłatna, czerwona, fioletowa lub czarna.
Masa atomowa
30 973 u
Liczba atomowa (z)
piętnaście
Temperatura topnienia
Biały fosfor: 44,15 ° C
Czerwony fosfor: ~ 590 ºC
Punkt wrzenia
Biały fosfor: 280,5 ° C
Gęstość (temperatura otoczenia)
Biały: 1823 g/cm3
Czerwony: 2,2-2,34 g/cm3
Fiolet: 2,36 g/cm3
Czarny: 2,69 g/cm3
Fusion Heat
Biały fosfor: 0,66 kJ/mol
Ciepło parowe
Biały fosfor: 51,9 kJ/mol
Pojemność kaloryczna trzonowa
Biały fosfor: 23 824 J/(mol.K)
Stany utleniania
-3, -2, -1, +1, +2, +3, +4 i +5
W zależności od elektroonywatywności elementów, z którymi fosfor może wykazywać stan utleniania +3 lub -3. Fosfor, w przeciwieństwie do azotu, ma tendencję do reagowania najlepiej ze stanem utleniania +5; Tak jest w przypadku pentoksydu fosforu (p2ALBO5 lub p25+ALBO52+).
Może ci służyć: rozpuszczalne materiałyElektronialiczność
2,19 na skali Paulinga
Energia jonizacji
-Po pierwsze: 1.101 kJ/mol
-Po drugie: 2.190,7 kJ/mol
-Po trzecie: 2.914 kJ/mol
Przewodność cieplna
Biały fosfor: 0,236 W/(M · K)
Czarny fosfor: 12,1 W/(M · K)
Pokazuje, w jaki sposób czarny fosfor przeprowadza prawie sześć razy więcej ciepła niż biały fosfor.
Zakon magnetyczny
Mecze białe, czerwone, fioletowe i czarne są diamagnetyczne.
Izotopy
Fosfor ma 20 izotopów, będąc głównymi: 31P, jedyny stabilny izotop o obfitości 100%; 32P, izotop β emitera- i z pół -liteą 14,28 dni; I 33P, izotop emitera β- I z pół -life wynoszącym 25,3 dni.
Fosforescencja
Biały fosfor jest fosforyzujący i emituje zielone światło w ciemności.
Zmiany alotropowe
Biały fosfor jest niestabilny i zmienia się w temperatury zbliżone do 250 ° C do kształtu polimerowego znanego jako czerwony fosfor, który może zmieniać pomarańczowy do fioletowej pomarańczowej pomarańczowej. Jest to substancja amorficzna, ale może stać się krystaliczna; Nie świeci w ciemności ani pali się w powietrzu.
Biały fosfor w wysokich temperaturach i ciśnieniach lub w obecności katalizatorów przekształca się w postać polimerową inną niż czerwony fosfor: czarny fosfor. Jest to czarna, obojętna krystaliczna substancja, podobna do grafitu, i ma zdolność do prowadzenia energii elektrycznej.
Rozpuszczalność
Biały fosfor jest nierozpuszczalny w wodzie, chociaż można go rozpuścić w siarczku węgla. Tymczasem mecze czerwone i czarne są nierozpuszczalne w wodzie i są mniej lotne niż biały fosfor.
Reaktywność
Fosfor spala się spontanicznie w powietrzu, tworząc p2ALBO5, A to z kolei może reagować z trzema cząsteczkami wody, tworząc kwas ortofosforowy lub fosforowy (H (H3PO4).
Przez działanie gorącej wody pochodzą z fosfiny (pH3) i fosfor oksydów.
Kwas fosforowy działa na fosforowane skały powodujące dihydrogen lub superfosforan fosforan wapnia [CA2PO4)2].
Możesz reakcja z halogenami, aby utworzyć halogendy PX3, reprezentujący X do F, Cl, Br lub I; o Halluros z formułą PX5, Bycie X, Cl lub BR.
Również fosfor reaguje z metali i metaloidami, powodując fosfory, a siarka tworzy kilka siarków. Z drugiej strony wiąże się z tlenem, aby powstać estry. W ten sam sposób jest łączony z węglem, tworząc związki organiczne fosforu.
Struktura elektroniczna i konfiguracja
- Linki i jednostka czworościenna
Atomy fosforu mają następującą konfigurację elektroniczną:
[Ne] 3s2 3p3
Dlatego pięć elektronów z Walencji, takich jak azot i inne elementy grupy 15. Ponieważ jest to element niemetaliczny, jego atomy muszą tworzyć kowalencyjne wiązania. Azot osiąga go, gdy jest ustalany jako cząsteczki datomic n2, Z potrójnym ogniwem, N≡N.
To samo dotyczy fosforu: dwa z jego atomów P są połączone z potrójnym wiązaniem z cząsteczką P2, P≡P; To jest alotrope difosforu. Jednak fosfor ma większą masę atomową niż azot i jego orbitale 3P, bardziej rozproszone niż 2p azotu, pokrywają się z mniejszą wydajnością; Dlatego p2 Istnieje tylko w stanie gazowym.
Zamiast tego w temperaturze pokojowej atomy p wolą organizować kowalencyjnie w inny sposób: w cząsteczce czworościennej p4:
 Jednostki molekularne P4 w białych kryształach fosforu. Źródło: Benjah-BMM27 przez Wikipedia.
Jednostki molekularne P4 w białych kryształach fosforu. Źródło: Benjah-BMM27 przez Wikipedia. Zauważ, że na obrazie doskonały wszystkie atomy P mają trzy proste linki zamiast potrójnego łącza. Zatem fosfor w P4 Wypełnij swoją Octeto de Valencia. Jednak w P4 W połączeniach P-P jest napięcie, ponieważ ich kąty trafiają do nagiego oka, by mieć 109,5 °.
- Alotropy
Biały fosfor
Ten sam obraz jednostek P4 A jego niestabilność wyjaśnia, dlaczego biały fosfor jest najbardziej niestabilnym wolnym z tego elementu.
Jednostki str4 Są one uporządkowane w przestrzeni, aby zdefiniować kryształ BCC (faza α) w normalnych warunkach. Gdy temperatura opada do -77,95 °. To znaczy jednostki p4 Są one zamówione w dwóch alternatywnych warstwach, A i B, aby ustanowić sekwencję ABAB ..
Czerwony fosfor
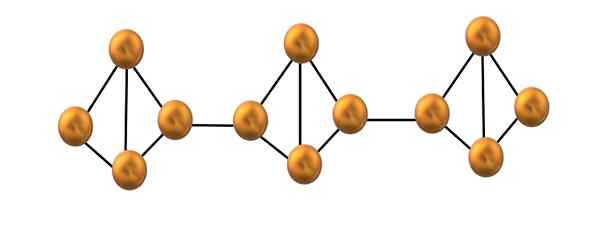 Struktura łańcucha czerwonego fosforu. Źródło: Gabriel Bolívar.
Struktura łańcucha czerwonego fosforu. Źródło: Gabriel Bolívar. Na górnym obrazie pokazano tylko mały segment struktury czerwonego fosforu. Będąc trzema jednostkami wyrównanymi „symetrycznie”, można powiedzieć, że jest to struktura krystaliczna, która jest uzyskiwana przez ogrzewanie tego fosforu powyżej 250 ° C.
Czerwony fosfor jednak przez większość czasu składa się z solidnego amorficznego, więc jego struktura jest nieuporządkowana. Tak więc łańcuchy polimerowe P4 Mieliby bez widocznego wzoru, jeden powyżej, a inne poniżej tej samej płaszczyzny arbitralnie.
Zauważ, że jest to główna różnica strukturalna między fosforem białym i czerwonym: w pierwszym4 Są indywidualne, aw drugim formującym się łańcuchach. Jest to możliwe, ponieważ jedno z linków P-P jest zepsute wewnątrz tetrahedronu, aby móc połączyć się z sąsiednim tetrahedronem. Zatem napięcie pierścieniowe i czerwony fosfor są zmniejszone większą stabilność.
Może ci służyć: cynk: historia, właściwości, struktura, ryzyko, użyciaGdy istnieje mieszanka obu alotropów, jest ona oferowana w zasięgu wzroku jako żółty fosfor; Mieszanina czworościaków i amorficznych łańcuchów fosforu. W rzeczywistości biały fosfor.
Fiolet lub fosfor hittorf
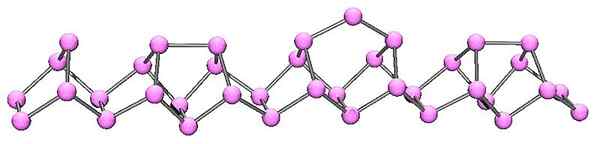 Struktura molekularna fioletowego fosforu. Źródło: kadm w angielskiej Wikipedii [domena publiczna]
Struktura molekularna fioletowego fosforu. Źródło: kadm w angielskiej Wikipedii [domena publiczna] Fioletowe fosfor to ostateczna ewolucja czerwonego fosforu. Jak widać na obrazie wyższym, nadal składa się z łańcucha polimerowego; Ale teraz struktury są bardziej skomplikowane. Wygląda na to, że jednostka strukturalna nie jest już P4 Ale p2, ułożone w taki sposób, że tworzą nieregularne pierścienie pięciokątne.
Pomimo tego, jak wyglądają asymetryczna struktura, te polimerowe łańcuchy udaje się wystarczająco dobrze i okresowo, aby fioletowe fosfor.
Czarny fosfor
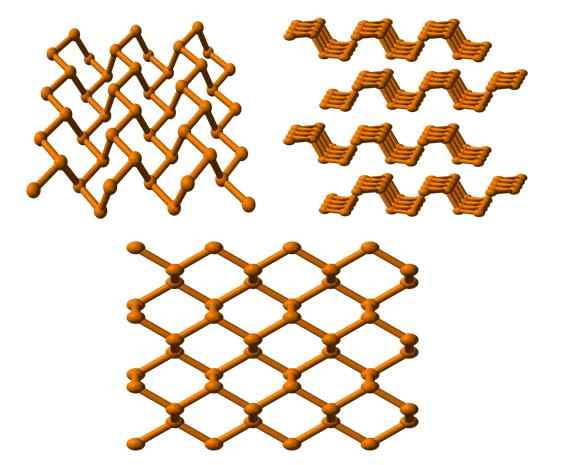 Czarna struktura fosforu widoczna z kilku kątów. Źródło: Benjah-BMM27 [domena publiczna].
Czarna struktura fosforu widoczna z kilku kątów. Źródło: Benjah-BMM27 [domena publiczna]. I wreszcie mamy najbardziej stabilny fosfor alotrope: czarny kolor. Przygotowuje biały fosfor pod ciśnieniem 12.000 atm.
Na górnym obrazie (poniżej) można zauważyć, że jego struktura, z wyższej płaszczyzny, ma pewne podobieństwo do grafitu; Jest to stroma sieć sześciokątnych pierścieni (chociaż wyglądają kwadratowe).
W lewym górnym rogu obrazu możesz lepiej docenić nowo skomentowane. Molekularne środowiska atomów P to trygonalna piramida. Zauważ, że widok struktury bocznie (prawy górny róg) jest ułożony w warstwach, które pasują do drugiej.
Struktura czarnego fosforu jest dość symetryczna i uporządkowana, co zgadza się z jego zdolnością do ustanowienia się jako kryształy ortorombowe. Układanie warstw polimerowych powoduje, że atomy P nie są dostępne dla wielu reakcji chemicznych; I dlatego jest znacznie stabilny i niewielki reaktywny.
Chociaż nie trzeba o tym wspomnieć, londyńskie siły dyspersji i masy molowe tych fosforowych stałych są te, które rządzą niektórymi z jego właściwości fizycznych; podczas gdy ich struktury i wiązania P-P definiują właściwości chemiczne i inne.
Gdzie to jest i uzyskaj
Apatita i fosfor
Jest to dwunastu elementów skorupy ziemskiej i reprezentuje 0,1% z wagi. Istnieje około 550 minerałów zawierających fosfor, a Apatita jest najważniejszym minerałem do uzyskania fosforu.
Apatita to fosfor i minerał wapnia, który może zawierać zmienne ilości fluoru, chlorku i wodorotlenku, którego wzór jest następujący: [Ca10(PO4)6(F, Cl lub OH)2)]. Oprócz apatytu istnieją inne minerały fosforu o znaczeniu handlowym; Tak jest w przypadku Wavelita i Vivianita.
Fosforan lub skała fosforytowa jest głównym źródłem fosforu. Jest to nieletnitowa skała osadowa, która ma 15-20% zawartość fosforu. Fosfor jest zwykle obecny jako CA10(PO4)6F2 (Fluoroapatita). Jest również obecny jako hydroksyapatyt, choć w mniejszym stopniu.
Dodatkowo fluoroapatyt można znaleźć część skał magmowych i metamorficznych, a także wapienia i łupków.
Elektrotermiczna redukcja fluoroapatita
Wybrane skały fosforanowe są przenoszone do oczyszczalni w celu przetwarzania. Początkowo są one zmiażdżone, aby uzyskać fragmenty skały, które są następnie mielone w młynach piłkarskich o 70 obrotach na minutę.
Następnie iloczyn szlifowania fragmentów skalnych jest zasieszany, aby móc je ułamać. Frakcje te są wybierane z 34% zawartością fosforu, takim jak pentoksyd fosforu (p2ALBO5).
Biały fosfor (str4) Jest uzyskiwany przemysłowo przez elektrotermiczną redukcję fluoroapatytu z węglem w temperaturze 1.500 ° C w obecności tlenku krzemu:
2ca3(PO4)2(s) + 6Sio2(s) + 10 c (s) => p4(g) + Casio3(L) + CO (G)
P4 W stanie gazowym, po skraplaniu, jest zbierany i przechowywany jako biała stała zanurzona w wodzie, aby zapobiec reakcji z zewnętrznym powietrzem.
Stopy
Miedziany
Pokrycie fosforu jest wytwarzane z różnymi odsetkami miedzi i fosforu: Cu 94 % - P 6 %; Cu 92% - P 8%; CU 85% - P 15% itp. Stop jest stosowany jako czynnik dezoksydacyjny, nawilżający dla przemysłu miedzi, a także jako nuklean w przemyśle aluminium.
Broncine
Są to stopy miedzi, fosforu i cyny zawierające 0,5–11% fosforu i 0,01 - 0,35% cyny. Cyna zwiększa odporność na korozję, a fosfor.
Jest stosowany w opracowaniu sprężyn, śrub i ogólnie w artykułach wymagających zmęczenia, zużycia i korozji chemicznej. Zalecane jest jego zastosowanie w śmigłach naczyń.
Może ci służyć: kadm (CD): historia, właściwości, struktura, zastosowaniaNictelladas
Najbardziej znanym stopem jest NIP20, Wykorzystanie fosforowanego niklu w silnych stopach spawania, w celu poprawy jego odporności na erozję chemiczną, utlenianie i wysokie temperatury.
Stop jest stosowany w elementach gazu i reakcji, galwanoplastyki oraz w produkcji elektrod spawalniczych.
Ryzyko
Biały fosfor wytwarza poważne oparzenia skóry i jest potężną trucizną, która może być śmiertelna w dawce 50 mg. Fosfor hamuje utlenianie komórek, zakłócanie zarządzania tlenem komórkowym, co może prowadzić do zwyrodnienia tłuszczu i śmierci komórki.
Ostre zatrucie fosforu wytwarza w ciągu pierwszych czterech dni od bólu brzucha, żar, oddech z zapachem czosnku, wymiotami fosforescencyjnymi, poceniem się, skurczami mięśni, a nawet stanu uderzenia.
Następnie żółtaczka, petechiae, krwotok, wpływ mięśnia sercowego z arytmiami, zmiana ośrodkowego układu nerwowego i śmierć w dziesiątym dniu spożycia objawia się.
Najbardziej oczywistym przejawem przewlekłego zatrucia fosforu jest uszkodzenie struktury kości szczęki.
Wzrost stężenia fosforu w osoczu (hiperfospathia) jest zwykle prezentowany u pacjentów z niewydolnością nerek. Powoduje to nieprawidłowy depozyt fosforanów w tkankach miękkich, co może prowadzić do dysfunkcji naczyniowej i chorób sercowo -naczyniowych.
Aplikacje
Fosfor jest niezbędnym elementem dla roślin i zwierząt. Jest to jeden z trzech głównych składników odżywczych roślin, które są niezbędne ze względu na ich wymagania dotyczące wzrostu i energii. Ponadto jest częścią kwasów nukleinowych, fosfolipidów, pośrednich produktów procesów metabolicznych itp.
U kręgowców fosfor występuje w kościach i zębach w postaci hydroksylapatytu.
- Elementarny fosfor
 Pudełko dopasowań lub „fosforu”. Źródło: Pxhere.
Pudełko dopasowań lub „fosforu”. Źródło: Pxhere. W przypadku fosforu wytwarzana jest emalia chemiczny, który jest wykorzystywany do oświetlenia zawiadomień umieszczonych na aluminium i jego stopach; a także w brązu miedzi i fosforowanym.
Służy również do wytwarzania bomb zapalających, granatów, pomp dymowych i kul. Czerwony fosfor jest stosowany w opracowaniu dopasowań bezpieczeństwa lub dopasowań.
Biały fosfor stosuje. Ponadto jest stosowany w produkcji kwasu fosforowego.
Duża ilość wytwarzanego fosforu spalana jest do produkcji tetaksku fosforu (str4ALBO10), uzyskane jako proszek lub stałe.
- Związki
Fosfina
Jest to surowiec do opracowania kilku związków fosforu. Działa jako środek dopingowy komponentów elektronicznych.
Kwas fosforowy
Jest używany w opracowaniu napojów bezalkoholowych ze względu na charakterystyczny smak. Działaj na skałach fosforanowych, tworząc dihydrogeny fosforan wapnia2PO4)2], znany również jako superfosforan, który jest stosowany jako nawóz.
Kwas fosforowy jest elementem odżywki szkliwa dentystycznego w celu ułatwienia przyczepności materiałów jego przywracania. Jest również używany, zmieszany z olejem, mocznikiem, pęknięciem, bitumem i piaskiem, aby utworzyć asfalt; Materiał używany w naprawie kanałów komunikacji lądowej.
FOROFOSHORUS
Związki organiczne mają wiele zastosowań; takie jak: opóźniacze płomienia, pestycydy, środki ekstrakcyjne, środki działania nerwowe i obróbka wody.
Dihydrat dihydrat fosforan wapnia
Jest stosowany jako nawóz, proszek do pieczenia, dodatek do żywności zwierząt oraz w opracowywaniu pasów dentystycznych.
Pentlenek fosforu
Jest stosowany w analizie chemicznej jako środek odwodniający i w syntezie organicznej jako środek skraplający. Związek jest głównie przydzielany do produkcji kwasu ortofosforowego.
Tripolifosforan sodu
Jest stosowany w detergentach i jako zmiękczacz wody, co poprawia działanie detergentów i pomaga uniknąć korozji rur.
Fosforan trisodyczny
Jest używany jako środek czyszczący i zmiękczacz wody.
Fosforany sodu
Dibasic Sodum Fosforan (na2HPO4) i monobazowy fosforan sodu (nah2PO4) są składnikami układu amortyzującego pH, który nawet działa w żywych istotach; Wśród nich ludzkie istoty.
Bibliografia
- Reid Danielle. (2019). Alotropy fosforu: formy, użycia i przykład. Badanie. Odzyskane z: Study.com
- Prof. Robert J. Lancashire. (2014). Wykład 5C. Struktura elementów, kontynuuj P, S i I. Odzyskane z: chem.Uwiimona.Edu.JM
- Byju's. (2019). Fosfor czerwony. Odzyskane z: Byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang i in. (2019). Elektroniczne właściwości strukturalne i optyczne wielowarstwowego niebieskiego fosforu: badanie pierwszego szczebla. Journal of Nanomaterials, vol. 2019, identyfikator artykułu 4020762, 8 stron. doi.Org/10.1155/2019/4020762
- Dr. Ciasto Stewan. (2019). Fakty elementów fosforu. Chemicool. Odzyskane z: Chemicool.com
- Wikipedia. (2019). Fosfor. Źródło: w:.Wikipedia.org
- Helmestine, Anne Marie, pH.D. (3 lipca 2019). Fakty fosforu (liczba atomowa 15 lub symbol elementu P). Odzyskane z: Thoughtco.com
- Linus Pauling Institute. (2019). Fosfor. Odzyskane z: LPI.Oregonstate.Edu
- Bernardo Fajardo str. & Héctor Lozano v. (S.F.). Krajowe fosforowe przetwarzanie skał do produkcji superfosforanu. [PDF]. Odzyskane z: bdigital.I.Edu.współ
- Redaktorzy Enyclopaedia Britannica. (16 listopada 2018 r.). Element chemiczny fosforu. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Reade International Corp. (2018). Stop miedziany (kubek). Odzyskane z: czyt.com
- KBM Affilips. (27 grudnia 2018 r.). Master Master Fosforus (NIP). Azom. Odzyskane z: azom.com
- Lentech b.V. (2019). Tabela okresu: fosfor. Odzyskane z: lentech.com
- Abhijit Naik. (21 lutego 2018 r.). Używanie fosforu. Odzyskane z: Scienceruck.com
- « Objaśnienie ciśnienia manometrycznego, wzory, równania, przykłady
- Pochodzenie kultury trincheras, cechy, religia, kultura »

