Struktura fosforanu sodu, właściwości, synteza,

- 2474
- 773
- Pani Gilbert Stolarczyk
On Fosforan sodu Jest to sól nieorganiczna, której wzorem chemicznym jest na3PO4. Otrzymuje także trójzodowe nazwy fosforanów (TSP za akronim w języku angielskim: Fosforan trisodowy) lub trybazowy fosforan sodu, ponieważ całkowicie nie ma zdolności do przekazywania jonów wodoru h+.
Podczas nawiązania do niego w liczbie mnogiej, fosforany sodu, mówi się o całym kompendium soli, uwodnione lub nie, pochodzi z interakcji elektrostatycznych między Na+ i PO43-. Niektóre z tych soli składają się nawet z pirofosforanów sodu lub polimerów nieorganicznych, które posiadają PO43- jako monomer.
 Zegar z kryształami fosforanu sodu. Źródło: Ondřej Mang [domena publiczna]
Zegar z kryształami fosforanu sodu. Źródło: Ondřej Mang [domena publiczna] Dlatego, chyba że nie zostanie dokonana specyfikacja, zawsze będzie odnosić się do Na3PO4, I nie do Nah2PO4, na2HPO4, Na4P2ALBO7 Nie żadna inna sól.
Górny obraz pokazuje wygląd fosforanu sodu, który wygląda na białe kryształy podobne do soli lub stolika, lub kupiony jako biały amorficzny proszek. Następnie3PO4 jest w stanie utworzyć kilka hydratów, będąc NA3PO4· 12H2Lub ten, który jest najbardziej sprzedawany.
Znajduje się głównie w przemyśle spożywczym, w detergentach, suplementach sportowych i służy jako hiperosmotyczny środek przeczyszczający.
[TOC]
Struktura chemiczna
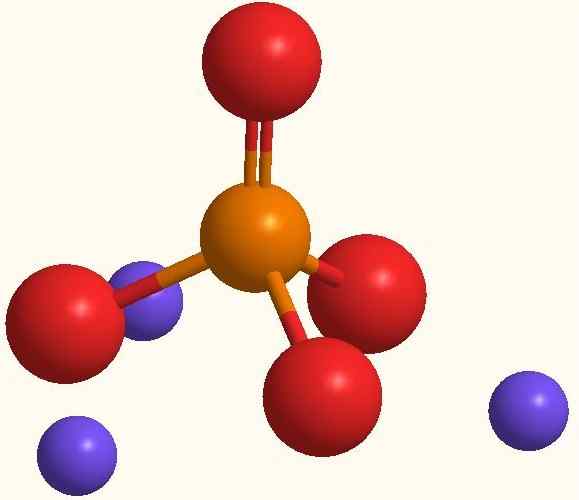 Główne jony fosforanu sodu. Źródło: Smolamj przez Wikipedia.
Główne jony fosforanu sodu. Źródło: Smolamj przez Wikipedia. Ta sama formuła Na3PO4 wskazuje, że dla każdego anionu PO43- Istnieją trzy kationów NA+. Jony te można zaobserwować na obrazie wyższym. Zauważ, że PO43- Ma geometrię czworościenną, z atomami tlenu z obciążeniem ujemnym rezonansowym, które przyciąga Na+ środowiska.
Również formuła Na3PO4 Wskazuje, że jest to bezwodna sól, więc w ich kryształach nie ma cząsteczek wody. Atrakcje elektrostatyczne między NA+ i PO43- Ostatecznie definiują trygonalny biały kryształ. Jego link jonowy jest taki, że Na3PO4 Ma punkt fuzji 1583 ° C, znacznie wyższy niż w kilku soli.
Może ci służyć: reakcja cannizzaro: cechy, mechanizmy, przykładyOba na+ Jak PO43- Są to jony, które można nawodnić w wysokim stopniu, bez negatywnego wpływu na stabilność kryształów.
Z tego powodu hydraty mogą również krystalizować; Jednak jego temperatury topnienia są niższe niż w bezwodnej soli, ponieważ międzycząsteczkowe mosty wodorowe wody oddzielają jony i osłabiają ich interakcje. W Na3PO4· 12H2Lub, na przykład, jego temperatura topnienia wynosi 73,4 °3PO4.
Nieruchomości
Wygląd fizyczny
Może wystąpić jako zdefiniowane białe kryształy lub jako kurz lub granulki o tym samym kolorze. Wszystkie fizyczne wielkości wyrażone poniżej nawiązują tylko do naiwnej soli3PO4.
Temperatura topnienia
1583 ° C
Punkt wrzenia
100 ° C
Rozpuszczalność wody
14,5 g/100 ml w 25 ° C, więc jest uważany za dość rozpuszczalny fosforan wodny. Jest jednak nierozpuszczalny w rozpuszczalnikach organicznych, takich jak etanol i disiarczkach węgla.
Gęstość
2536 g/cm3 przy 17,5 ° C.
Stabilność
Jest to higroskopijne stałe. Dlatego musi być przechowywane w taki sposób, że nie można go wystawić na wilgoć.
Ph
Jest to silnie alkaliczna sól. Na przykład jego wodny roztwór 0,1% ma już pH 11,5. Ta właściwość służy jako dodatek w detergentach.
Synteza
Jak wytwarzany lub syntetyzowany jest fosforan sodu? W tym celu opiera się na kwasie fosforowym, h3PO4, lub z soli soli solnej, nie, nie2PO4.
W zdecydowanej większości syntezy H jest preferowane3PO4. W ten sposób H reaguje3PO4 Z podstawą, która zneutralizuje trzy grupy OH, biorąc pod uwagę, że ten kwas można również zapisać jako PO (OH)3.
Może ci służyć: Bilans tematu: co to jest, równanie ogólne, typyPodstawą preferencyjną jest wodorotlenek sodu, NaOH (w Niemczech), ale jest również opłacalny (i tańszy) w użyciu węglanu sodu lub popiołu Sosy, Na, Na2WSPÓŁ3 (w Stanach Zjednoczonych). Równania obu reakcji neutralizacji to:
Na2WSPÓŁ3 + H3PO4 → na2HPO4 + WSPÓŁ2 + H2ALBO
Na2HPO4 + Naoh → na3PO4 + H2ALBO
Zauważ, że podczas korzystania z NA2WSPÓŁ3 Na nie jest uzyskiwane3PO4 Ale na2HPO4, które będą wymagały późniejszej neutralizacji. Będąc reakcją wodną, krystalizuje Na3PO4· 12H2Lub, należy więc obliczyć, aby wyeliminować zawartość wody i spowodować bezwodną sól.
Następnie3PO4· 12H2O Charakteryzuje się „połączeniem” swoich kryształów w trudnej kompaktowej masie. Im mniejszy rozmiar ich kryształów, tym szybciej będzie kalcynacja.
Aplikacje
Żywność
 Fosforan sodu jest stosowany jako musujący środek do rozszerzenia ról cynamonowych lub ciastek. Źródło: Pixabay.
Fosforan sodu jest stosowany jako musujący środek do rozszerzenia ról cynamonowych lub ciastek. Źródło: Pixabay. W zastosowaniu fosforanu sodu jest nieuniknione do wymieszania Na3PO4 lub na3PO4· 12H2Lub, ponieważ ten ostatni jest hydratem, który jest najbardziej sprzedawany. Na przykład jeden z tych dwóch zapewnia nieszkodliwe (teoretycznie) jony do jedzenia, do którego są dodawane, wzbogacając je z fosforanów, a jednocześnie zwiększają ich zasolenie.
W salarach mięs, na3PO4· 12H2Lub jest wliczone w celu utrzymania ich świeżego na dłużej podczas przechowywania. Jest również dodawany jako środek emulgujący, aby mieszanka olej-woda nie była „wycięta”, ale pozostaje zjednoczona; Oraz jako regulator pH, ponieważ pomaga zmniejszyć kwasowość żywności (w tym zbóż).
Może ci służyć: krzemian wapnia: właściwości, struktura, uzyskiwanie, użyciaPonadto służy go do zagęszczania niektórych sosów pomidorowych oraz do pieczenia ciasta lub chleba (obraz doskonały). Ten ostatni jest tak, ponieważ Na3PO4· 12H2Lub ma tendencję do uwalniania pary wodnej, która zwiększa rozmiar porów masy mąki i objętość tego samego.
Detergenty
Fosforan sodu jest wystarczająco podstawowy, aby saponizować niektóre tłuszcze lub oleje, z którymi masz kontakt. Jego zasadowość jest następnie wykorzystywana do poprawy działania detergentów, o ile powierzchnia nędza nie jest metalowa, ponieważ mogą ją pogorszyć.
Jednak produkcja detergentów wzbogaconych w fosforany została zmniejszona, ponieważ wytwarzają eutrofizację jezior i rzek, a wraz z nimi proliferacja glonów, które obejmują ich powierzchnie.
Został również użyty do opracowania środka dezynfekującego: na3PO4· 1/4NAOCl · 11H2Lub, który jest przygotowywany przy użyciu podchlorynu sodu, NaOCl, zamiast NaOH lub Na2WSPÓŁ3 Zneutralizować h3PO4.
Leczniczy
Następnie3PO4 Indukuje defekację, działając jako hiperosmotyczny środek przeczyszczający, niezbędny do wyczyszczenia okrężnicy, zanim pacjent przejdzie kolonoskopię. Z drugiej strony został również wykorzystany (dodany) w suplementach energii.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- National Center for Biotechnology Information. (2019). Fosforan trisodowy. Baza danych Pubchem. CID = 24243. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Wikipedia. (2019). Fosforan trisodowy. Źródło: w:.Wikipedia.org
- Curran m.P. & Plosker g.L. (2004). Roztwór do jamy ustnej fosforanu sodu: przegląd jego zastosowań do czyszczenia jelita grubego. Doi: 10.2165/00003495-200464150-00009
- Corey Whelan. (22 grudnia 2017 r.). Fosforan sodu. Odzyskane z: Healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Proces produkcji fosforanu trisod. Pobrano z: Freepatentssonline.com
- Maryann Marks. (2018). Dlaczego do naszego jedzenia dodaje się fosforan trisodowy (TSP)? Odzyskane z: TheingRedientGuru.com

