Struktura fluorku magnezu, właściwości, synteza,
- 2879
- 138
- Herbert Wróblewski
On Fluor magnezowy Jest to bezbarwna sól nieorganiczna, której mieszanką chemiczną jest MGF₂. Występuje w naturze jako minerał SEALíta. Ma bardzo wysoki punkt fuzji i jest bardzo mało rozpuszczalny w wodzie. Jest stosunkowo obojętna, ponieważ na przykład jego reakcja na kwas siarkowy jest powolny i niekompletna i odpowiada hydrolizy kwasem fluorowym (HF) do 750ºC.
Jest to związek mało dotknięty promieniowaniem o wysokiej energii. Ponadto ma niski wskaźnik refrakcji, wysoką odporność na korozję, dobrą stabilność termiczną, znaczącą twardość i doskonałe właściwości transmisji światła widzialnego, UV (ultrafiolet) i IR (podczerwień).

Właściwości te mają doskonałą wydajność w polu optycznym, a ponadto sprawiają, że jest to przydatny materiał, taki jak obsługa katalizatora, element powlekania, soczewki antyrefleksowe i okna do transmisji w podczerwieni, między innymi.
[TOC]
Struktura
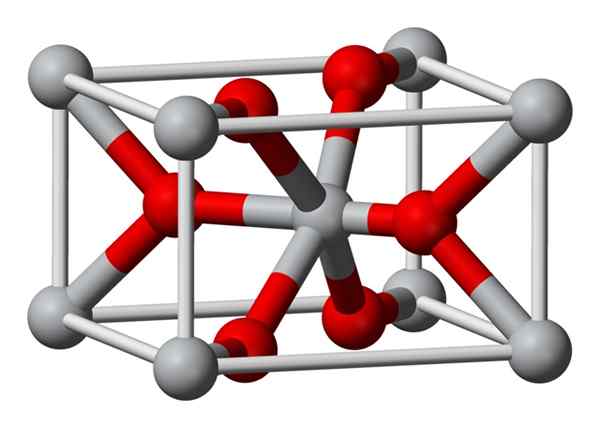
Krystaliczna struktura fluorku magnezu przygotowanego chemicznie jest tym samym typem, co struktura naturalnego minerału Sellaíta. Krystalizuje w klasie dipiramidalnej układu tetragonalnego.
Jony magnezu (MG2+) znajdują się w skoncentrowanym na tetragonie przestrzeni, podczas gdy jony fluorkowe (F-) znajdują się w tej samej płaszczyźnie ich sąsiadów Mg2+ i związane z nimi, zgrupowane w pary z każdym z nich. Odległość między jonami Mg2+ i F-F-2,07 Å (Angstroms) (2,07 × 10-10 m).
Jego krystaliczna koordynacja wynosi 6: 3. Oznacza to, że każdy jon Mg2+ jest otoczony 6 jonów f-, a każdy jon f- jest otoczony 3 mg2+ 5 jonów.
Struktura jest bardzo podobna do minerału Rutilo, która jest naturalną formą dwutlenku tytanu (TiO2), z którym ma kilka wspólnych właściwości krystalicznych.
Podczas uzyskiwania fluorek magnezu nie wytrąca się w postaci amorficznej substancji stałej, ponieważ Mg2+ i F-jonów nie tworzą kompleksów polimerowych w roztworze.
Nieruchomości
Ciekawe jest podkreślenie, że fluorek magnezu jest materiałem o ptakach. Jest to właściwość optyczna, która pozwala rozwinąć promień padającego światła na dwa oddzielne promienie, które rozprzestrzeniają się na różnych falach i długościach fal.
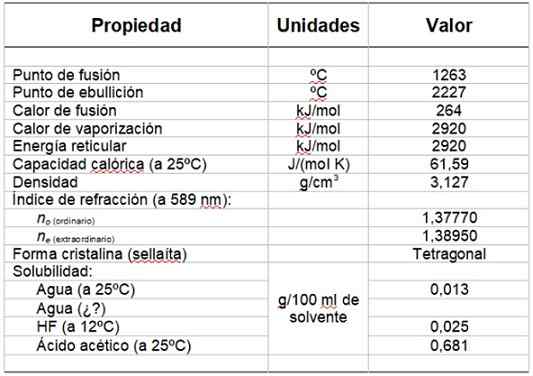
Może ci służyć: grupa hydroksylowaTabela 1 pokazuje niektóre z jego właściwości.
Tabela 1. Właściwości fizyczne i chemiczne fluoru magnezu.
Synteza i przygotowanie
Można go przygotować na kilka sposobów, wśród których można wymienić następujące:
1, bo reakcja między tlenkiem magnezu (MGO) lub węglanem magnezu (MGCO3) za pomocą kwasu fluorkowego (HF) 2:
MGO + 2 HF MGF2 + H2O
MGCO3 + 2 HF MGF2 + CO2 + H2O
2-reakcja między węglanem magnezu a bifluoruro amonu (NH4HF2), oba w stanie stałym, w temperaturze między 150 a 400ºC2:
150-400ºC
MGCO3 + NH4HF2 MGF2 + NH3 + CO2 + H2O
3-Calento wodny roztwór węglanu magnezu i fluoru amonu (NH4F) w obecności wodorotlenku amonu (NH4OH) w 60ºC 2:
60ºC, NH4OH
MGCO3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
Osad fluorku amonu i magnezu (NH4MGF3) jest następnie ogrzewany do 620ºC przez 4 godziny w celu uzyskania fluorku magnezu:
620ºC
NH4MGF3 MGF2 + NH3 + HF
4-jako produkt uboczny uzyskiwania berylu (BE) i uran (U). Fluor pożądanego pierwiastka z metalicznym magnezem ogrzewa się w tylnym garbku MGF2 2:
Bef2 + mg be + mgf2
5-hacie react chlorek magnezu (MGCL2) z fluorkiem amonu (NH4F) w roztworze wodnym w temperaturze pokojowej 3:
25ºC, H2O
MGCL2 + 2 NH4F MGF2 + 2NH4Cl
Ponieważ metody przygotowania MGF2 są drogie, istnieją próby uzyskania go bardziej ekonomicznie, wśród metody wytwarzania go z wody morskiej.
Może ci służyć: wodorek wapnia (CAH2): właściwości, reaktywność i zastosowaniaCharakteryzuje się dodaniem wystarczającej ilości jonów fluorkowych (F-) do wody morskiej, która ma obfite stężenie jonów magnezu (mg2+), faworyzując w ten sposób wytrącanie Mgf2.
Optyczne kryształy fluorku magnezu uzyskuje się przez gorące ciśnienie z wysokiej jakości MGF2, na przykład, metodą NH4HF2.
Istnieje wiele technik przygotowywania materiałów fluorkowych magnezu, takich jak wzrost pojedynczego szkła, spiekanie (zagęszczenie do pleśni lub kształtu) bez ciśnienia, gorące i spiekania prasowane mikrofalami.
Aplikacje
Optyka
Kryształy MGF2 są odpowiednie do zastosowań optycznych, ponieważ są przezroczyste z regionu UV do średnio 2,10 regionu IR.
Gdy folia obojętna służy do zmiany właściwości transmisji światła materiałów optycznych i elektronicznych. Jedna z głównych aplikacji jest Vuv Optics for Space Exploration Technology.
Ze względu na swoją właściwość Birrefringency, materiał ten jest przydatny w optyce polaryzacji, w oknach laserowych i pryzmatach ECimer (typ lasera ultrafioletowego stosowany w operacji oka).
Należy zauważyć, że fluorek magnezu stosowany w produkcji materiałów optycznych cienkiej warstwy musi być wolny od zanieczyszczeń lub związków, które są źródłem tlenku, takich jak woda (H2O), jony wodorotlenkowe (OH-), jony węglanowe (CO3 = ), Jony siarczanu (SO4 =) i podobne 12.
Kataliza lub przyspieszenie reakcji
MGF2 z powodzeniem zastosowano jako wsparcie katalizatora reakcji eliminacji chloru i dodawania wodoru w CFC (chlorofluorokarbony), dobrze znanych czynników chłodniczych i paliwach aerozolu oraz odpowiedzialny za uszkodzenie warstwy ozonowej atmosfery atmosfery.
Powstałe związki, HFC (hydrofluorokarbony) i HCFC (hydrochlorofluorokarbony), nie stanowią tego szkodliwego efektu atmosfery 5.
Był również przydatny jako wsparcie dla katalizatorów do hydroduSulfration (eliminacja siarki) związków organicznych.
Może ci służyć: Bilans chemiczny: wyjaśnienie, czynniki, typy, przykładyInne zastosowania
Materiały generowane przez grafit, fluor i przeplatanie MGF2.
Eutktyka utworzona przez NAF i MGF2 przedstawia właściwości magazynowania energii w utajonym cieple, więc jest rozważany do stosowania w systemach energii słonecznej.
W obszarze biochemii fluorkel magnezowy, wraz z innymi metalowymi fluorkami, stosuje się do hamowania reakcji przenoszenia fosforylu w enzymach.
Ostatnio nanocząstki MGF2 zostały pomyślnie przetestowane jako wektory umieszczania leków w komórkach chorych do leczenia raka.
Bibliografia
- Buckley, godz.I. i Vernon, w.S. (1925) Xciv. Struktura krystaliczna fluorku magnezu. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, Tom 11, Fifth Edition, John Wiley & Sons. ISBN 0-471-52680-0 (v.jedenaście).
- Peng, Minhong; Cao, Weiping; i Song, Jinhong. (2015). Przygotowanie półprzezroczystej ceramiki MGF2 przez gorące naciskające spiekanie. Journal of Wuhan University of Technology-Mater: SCI. Wyd. Tom. 30 nie. 4.
- Непоконia, и.С. (2011). Fluorkowy magnez. Źródło: własna praca.
- Wojciechowska, Maria; Zieliński, Michal; i Piettowski, Mariusz. (2003). MGF2 jako niekonwencjonalne wsparcie katalizatora. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle Gmbh. (2019). Fluorkowy magnez (MGF2). Skonsultowano się z 07.12.2019 w: Korth.z
- Sevonkaev, Igor i Matijevic, Egon. (2009). Tworzenie cząstek fluorku magnezu o różnych morfologiach. Langmuu 2009, 25 (18), 10534-10539.
- Непоконia, и.С. (2013). Fluorkowy magnez. Źródło: własna praca.
- Tao Qin, Peng Zhang i Weiwei Qin. (2017). Nowa metoda syntezy tanich kurek fluorku magnezu z wody morskiej. Ceramics International 43 (2017) 14481-14483.
- Ullmann's Encyclopedia of Industrial Chemistry (1996) Piąta edycja. Tom A11. VCH Verlagsgellschaft MBH. Nowy Jork. ISBN 0-89573-161-4.
- NASA (2013). Inżynierowie sprawdzający główny lustro Hubble Space Telescope 8109563. Źródło: Mix.MSFC.garnek.Gov
- « Piktograficzne pochodzenie, cechy i przykłady
- Charakterystyka transakcji komercyjnych i przykłady »

