Współczynnik ściśliwości Jak obliczyć, przykłady i ćwiczenia
- 4228
- 403
- Arkady Sawicki
On Współczynnik ściśliwości z, o Współczynnik kompresji dla gazów, jest wartością bezwymiarową (bez jednostek), która jest wprowadzana jako korekta w równaniu stanu gazów idealnych. W ten sposób model matematyczny przypomina bardziej obserwowane zachowanie gazu.
W gazie idealnym równanie stanu, które odnosi się do zmiennych P (ciśnienie), V (objętość) i t (temperatura) wynosi: P.V ideał = n.R.T z n = liczbą moli i r = stała gazów idealnych. Dodając korektę współczynnika kompresji Z, równanie to jest przekształcane w:
P.V = z.N.R.T
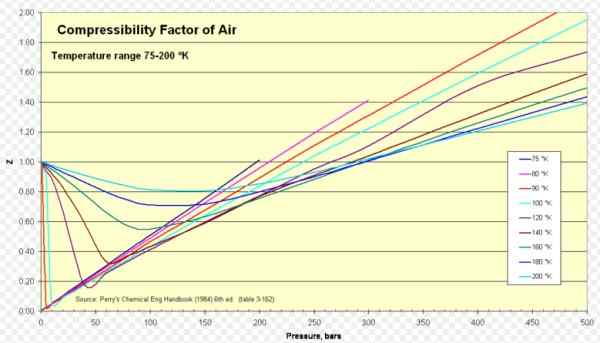
 Rysunek 1. Współczynnik ściśliwości powietrza. Źródło: Wikimedia Commons. https: // prześlij.Wikimedia.org/wikipedia/commons/8/84/Cortspressibility_factor_of_air_75-200_k.Png.
Rysunek 1. Współczynnik ściśliwości powietrza. Źródło: Wikimedia Commons. https: // prześlij.Wikimedia.org/wikipedia/commons/8/84/Cortspressibility_factor_of_air_75-200_k.Png. [TOC]
Jak obliczyć współczynnik ściśliwości?
Biorąc pod uwagę, że wolumen molowy jest VFajny = V/n, Masz prawdziwą objętość molową:
P . Vprawdziwy = Z. R. T → Z = PV prawdziwy/Rt
Ponieważ współczynnik ściśliwości Z zależy od warunków gazowych, jest wyrażany jako funkcja ciśnienia i temperatury:
Z = z (p, t)
Porównując pierwsze dwa równania, zauważa się, że jeśli liczba moli n jest równa 1, objętość molowa prawdziwego gazu jest związana z objętością gazu idealnego przez:
Vprawdziwy / Videał = Z → v prawdziwy = Z videał
Gdy ciśnienie przekracza 3 atmosfery, większość gazów przestaje zachować się jak gazy idealne, a rzeczywistą objętość różni się znacznie od ideału.
To zrealizowało w jego eksperymentach holenderski fizyk Johannes van der Waals (1837–1923), co doprowadziło go do stworzenia modelu, który lepiej dostosował się do wyników praktycznych niż równanie gazów idealnych: równanie stanu Van der Waalsa.
Może ci służyć: szczawian sodu (Na2C2O4): struktura, właściwości, zastosowania, ryzykoPrzykłady
Zgodnie z równaniem P.Vprawdziwy= Z.N.Rt, Dla gazu idealnego z = 1. Jednak w prawdziwych gazach poprzez zwiększenie ciśnienia wykonuje również wartość z. Ma to sens, ponieważ przy większym ciśnieniu cząsteczki gazu mają więcej możliwości zderzenia, dlatego siły odpychania rosną, a tym samym objętość.
Z drugiej strony do niższych ciśnień, cząsteczki poruszają się z większą swobodą, a siły odpychania zmniejszają. Dlatego oczekuje się niższej objętości. Jeśli chodzi o temperaturę, gdy wzrasta, Z maleje.
Jak zauważył van der Waals, w pobliżu SO -Caled Critical Punkt, zachowanie gazowe jest bardzo odwrócone z gazu idealnego.
Punkt krytyczny (tC, PC) dowolnej substancji są wartości ciśnienia i temperatury, które określają ich zachowanie przed zmianą fazy:
-TC Jest to temperatura, powyżej, dany gaz nie jest upłynniony.
-PC Jest to minimalne ciśnienie wymagane do upłynnienia gazu w temperaturze tC
Każdy gaz ma jednak swój własny punkt krytyczny, definiując temperaturę i zmniejszone ciśnienie tR I pR następująco:
PR = P / pC
VR = V /vC
TR = T /tC
Obserwuje się, że gaz ograniczony do identycznych VR I TR wywierać ten sam ciśnienie PR. Z tego powodu, jeśli Z jest graficzny w zależności od PR do tego samego TR, Każdy punkt w tej krzywej jest taki sam dla każdego gazu. To się nazywa Zasada odpowiednich stanów.
Współczynnik ściśliwości w gazach idealnych, powietrza, wodoru i wodzie
Poniżej znajduje się krzywa ściśliwości dla różnych gazów w różnych zmniejszonych temperaturach. Następnie kilka przykładów Z dla niektórych gazów i procedury do znalezienia Z za pomocą krzywej.
Może ci służyć: wodór: historia, struktura, właściwości i zastosowania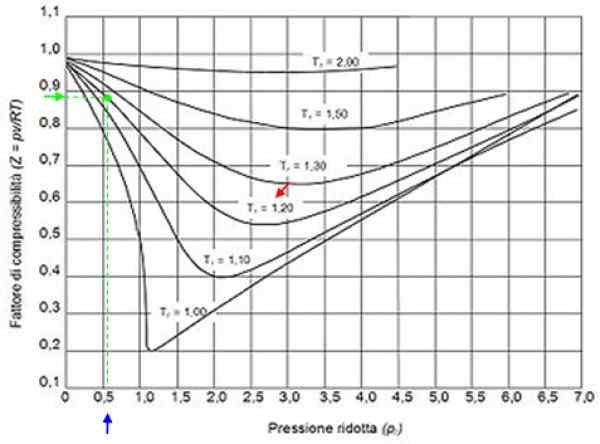 Rysunek 2. Grafika graficzna grafiki dla gazów zgodnie z ciśnieniem redukcyjnym. Źródło: Wikimedia Commons.
Rysunek 2. Grafika graficzna grafiki dla gazów zgodnie z ciśnieniem redukcyjnym. Źródło: Wikimedia Commons. Gazy idealne
Gazy idealne mają z = 1, jak wyjaśniono na początku.
Powietrze
Dla powietrza Z wynosi około 1 w szerokim zakresie temperatur i ciśnień (patrz ryc. 1), w którym model idealnego gazu daje bardzo dobre wyniki.
Wodór
Z> 1 dla wszystkich ciśnień.
Woda
Aby znaleźć Z wody, potrzebne są wartości punktu krytycznego. Krytycznym punktem wody jest: PC = 22.09 MPA i TC= 374.14 ° C (647.3 K). Ponownie należy wziąć pod uwagę, że współczynnik ściśliwości Z zależy od temperatury i ciśnienia.
Załóżmy na przykład, że chcesz znaleźć Z z wody w temperaturze 500 ° C i 12 MPa. Następnie pierwszy jest obliczenie obniżonej temperatury, dla których stopnie Celsjusza należy przekazać Kelvinowi: 50 ºC = 773 K:
TR = 773/647.3 = 1.2
PR = 12/22.09 = 0.54
Z tymi wartościami lokalizujemy na wykresie rysunku krzywa odpowiadająca tR = 1.2, wskazane z czerwoną strzałką. Następnie patrzymy w osi poziomej wartości pR bliżej 0.54, zaznaczone na niebiesko. Teraz rysujemy pionowo, aż do przechwytywania krzywej TR = 1.2 i wreszcie jest rzutowane od tego momentu do osi pionowej, gdzie odczytujemy przybliżoną wartość Z = 0.89.
Rozwiązane ćwiczenia
Ćwiczenie 1
Istnieje próbka gazu w temperaturze 350 K i ciśnienie 12 atmosfery, z objętością molową o 12 % wyższą niż przewidywana przez prawo gazów idealnych. Oblicz:
a) współczynnik kompresji Z.
b) Objętość molowa gazu.
Może ci służyć: nieodwracalna reakcja: cechy i przykładyc) Zgodnie z powyższymi wynikami wskazuj, które są dominującymi siłami w tej próbce gazowej.
Dane: r = 0,082 l.ATM/MOL.K
Rozwiązanie
Znając to v prawdziwy jest o 12 % wyższy niż Videał :
Vprawdziwy = 1.12videał
Z = v prawdziwy / Videał = 1.12
Rozwiązanie b
P . Vprawdziwy = Z. R. T → Vprawdziwy = (1.12 x 0.082 x 350 /12) L /mol = 2.14 l/mol.
Rozwiązanie c
Siły odpychania to te, które dominują, ponieważ objętość próbki wzrosła.
Ćwiczenie 2
Istnieje 10 moli etanu ograniczonych w objętości 4.86 L A 27 ºC. Znajdź ciśnienie wywierane przez etan z:
a) Model gazu idealnego
b) równanie van der waals
c) Znajdź współczynnik kompresji z poprzednich wyników.
Dane dla etanu
Van der Waals Współczynniki:
A = 5.489 DM6. bankomat . mol-2 i b = 0.06380 DM3. mol-1.
Presja krytyczna: 49 atm. Temperatura krytyczna: 305 K
Rozwiązanie
Temperatura jest przekazywana do Kelvina: 27 º C = 27 +273 K = 300 K, pamiętaj również, że 1 litr = 1 l = 1 dm3.
Następnie wymieniono dane dostarczone w równaniu gazowym:
P.V = n.R.T → P = (10 x 0,082 x 300/4.86 L) ATM = 50.6 atm
Rozwiązanie b
Równanie stanu Van der Waals to:
Gdzie A i B są współczynnikami podawanymi przez stwierdzenie. Podczas oczyszczania P:
Rozwiązanie c
Obliczamy zmniejszone ciśnienie i temperaturę:
PR = 35.2/49 = 0.72
TR = 300 /305 = 0.98 ≈ 1
Przy tych wartościach poszukiwana jest wartość Z na wykresie na ryc. 2, stwierdzenie, że Z wynosi około 0.7.
Bibliografia
- Atkins, str. 1999. Chemia fizyczna. Omega Editions.
- Cengel i. 2012. Termodynamika. 7mama Wydanie. McGraw Hill.
- Engel, t. 2007. Wprowadzenie do fizykochemii: termodynamika. osoba.
- Levine, ja. 2014. Zasady chemii fizyki. 6th. Wydanie. McGraw Hill.
- Wikipedia. Współczynnik ściśliwości. Źródło: w:.Wikipedia.org.

