Struktura etanamidu, właściwości, zastosowania, efekty
- 3450
- 855
- Estera Wojtkowiak
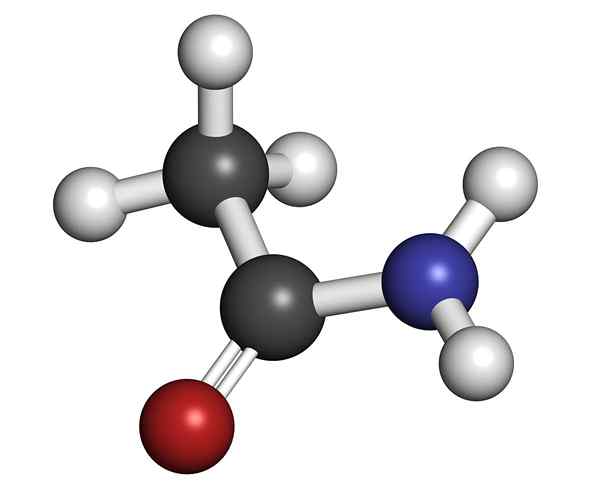
etanamid Jest to substancja chemiczna, która należy do grupy związków organicznych azotu. Według Międzynarodowej Związku Chemii Pure and Applied (IUPAC) nazywa się to również acetamidem (IUPAC). Handlowo nazywa się kwasem octowym.
Nazywa się to amida, ponieważ azot jest powiązany z grupą karbonylową. Jest pierwotny, ponieważ zachowuje dwa atomy wodoru zjednoczone z azotem -NH2. Został znaleziony w naturze jako minerał tylko w czasie suchego; W deszczowym lub bardzo wilgotnym sezonie rozpuszcza się w wodzie.
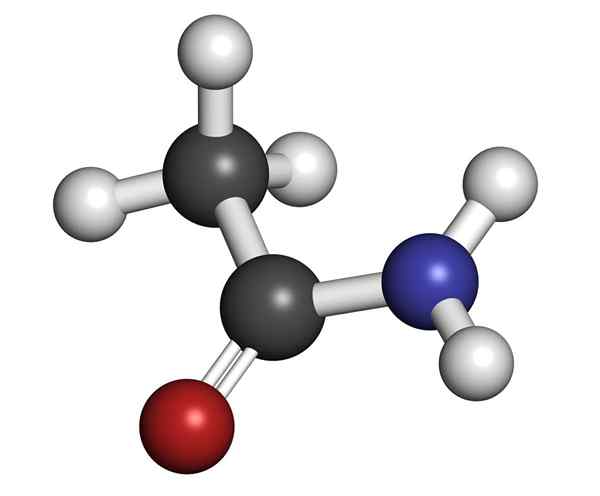 Struktura molekularna acetamidu
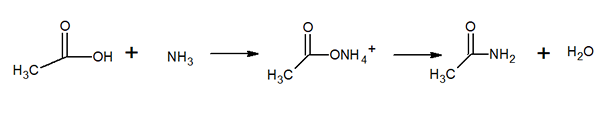
Struktura molekularna acetamidu Jest to szkliste stałe (przezroczyste). Jego kolor przechodzi od bezbarwnych do szarości, tworzy małe stalaktyty, a czasem ziarniste agregaty. Może wystąpić przez reakcję między kwasem octowym a amoniakiem, tworząc sól pośrednia: octan amonu. Następnie jest to odwodnione w celu wytworzenia amidy i tworzenia wody:
[TOC]
Struktura chemiczna
Wewnętrzna struktura chemiczna kryształu acetamidu jest trygonalna, ale przy łączeniu się w celu utworzenia aglomeratów nabiera kształtu oktaedrycznego.
Strukturalny wzór związku składa się z grupy acetylowej i grupy aminowej:
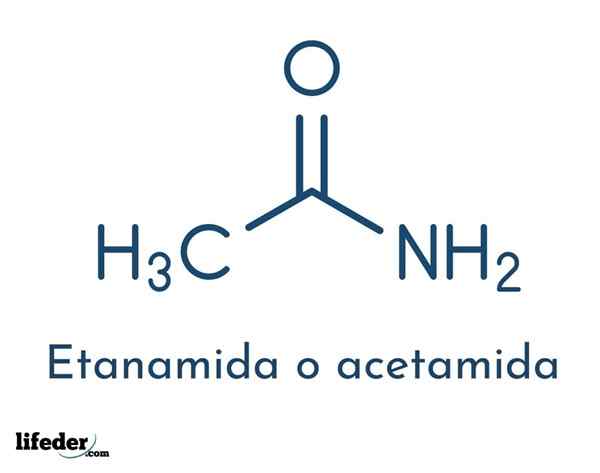
Grupy te pozwalają na różne reakcje, które można przeprowadzić związek. Molekularny wzór acetamidu wynosi C2H5NIE.
Fizyczne właściwości etanamidu
Wygląd | Są kryształami, które wahają się od bezbarwnych do szarości. |
Zapach | Toaleta. Kiedy ma zanieczyszczenia, ma zapach amoniaku. |
Pomysł | Można go znaleźć w naturze, oprócz kopalń w korzeniach buraków cukrowych, w winie, które utleniło się w nadmiarze, oraz w dymie tytoniu. |
Masa cząsteczkowa | 59.07 g/ml |
Gęstość wody | 1.159 g/cm³ |
Temperatura topnienia | Między zakresem 79 ° C-81 ° C |
Punkt wrzenia | 221 ° C |
Rozpuszczalność w wodzie, etanol, pirydyna, chloroform, glicerol i benzen | Bardzo rozpuszczalny |
Ciśnienie pary | 1.3x10-5 atm. |
Właściwości chemiczne
Właściwości chemiczne substancji odnoszą się do ich reaktywności, gdy są one w obecności innych, które mogą powodować transformację w jej strukturę. Acetamid przedstawia następujące reakcje:
Może ci służyć: Faraday ConstantKwas i podstawowa hydroliza
W hydrolizy kwasowej reaguje z kwasem nieorganicznym w wysokiej temperaturze, tworząc kwas karboksylowy i sól amonu.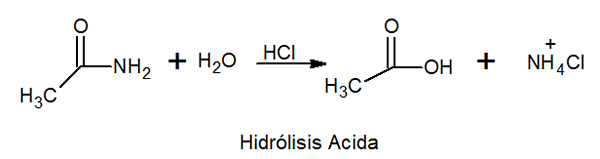
W podstawowej hydrolizy występują sól metali i amoniaku.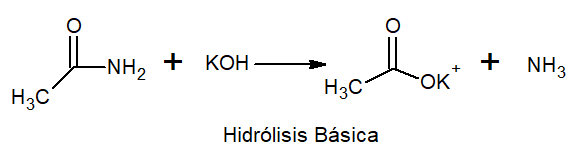
Zmniejszenie
Redukcja oznacza wzrost wodoru, więc ta reakcja wytwarza pierwotną aminę zwaną etanaminą lub etyloaminą. Reducer to wodorek litowy i aluminiowy lialh4. 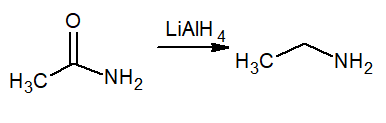
Odwodnienie
Termin ten wskazuje na utratę wody z cząsteczki. Są one stosowane jako odczynniki odwadniające chlorek tionilo (SOCL2) lub fosfor pentoksyd (p2ALBO5). Produktem końcowym jest nitryl. 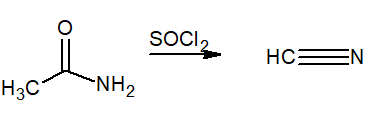
W polu przemysłowym produkcja kwasów karboksylowych jest bardzo korzystna ze względu na znaczenie jego pochodnych. Jednak uzyskanie kwasu etanowego z acetamidu ma bardzo ograniczone zastosowanie, ponieważ wysokie temperatury, do których występuje proces, mają tendencję do rozkładania kwasu.
W laboratorium, chociaż etanamid można uzyskać z kwasu octowego, odtworzenie kwasu amidu jest bardzo mało prawdopodobne, a na ogół jest to dla wszystkich amidów.
Może ci służyć: ititrium: struktura, właściwości, użycie, uzyskiwanieZastosowanie acetamidu
Acetamid wystąpił komercyjnie od 1920 r., Chociaż nie jest pewne, że do tej pory jest w użyciu komercyjnym. Wcześniej był stosowany do syntezy metyloaminy, tioacetamidu, hipnotyków, środków owadobójczych i do celów leczniczych.
Acetamid jest związek, który w polu przemysłowym jest stosowany jako:
- Uprawienie, w skórze, filmach i powłokach.
- Dodatek papierowy, aby zapewnić opór i elastyczność.
- Denaturacja alkoholi. Jest dodawany do alkoholu w badaniu, aby usunąć część czystości, którą ma, a zatem może podawać inne zastosowania, takie jak rozpuszczalnik.
- Lakier, aby zabłysnąć na powierzchnie i/lub chronić materiały przed agresją środowiska, zwłaszcza korozję.
- Materiał wybuchowy.
- Założyciel, odkąd dodanie do substancji ułatwia fuzję tego.
- W krioskopii.
- Jako pośrednia w opracowywaniu leków, takich jak ampicylina i antybiotyki pochodzące z cefalosporyny, takie jak: ból głowy, cefaleksyna, ciepło, enalaprylowe gałęzione (leczenie nadciśnienia) i sulfacetamid (przeciwdrobnoustrojowe krople ophthalmiczne),.
- Rozpuszczalnik, ponieważ niektóre substancje zwiększają rozpuszczalność w wodzie, gdy acetamid jest w nim rozpuszczony.
- Jako rozpuszczalnik, który naprawia barwniki w branży tekstylnej.
- W opracowaniu metyloaminy.
- Jako biocjde, w związkach, które można stosować jako środki dezynfekujące, konserwatywy, pestycydy itp.
Efekty zdrowotne
W przemyśle chemicznym, w którym acetamid jest stosowany jako rozpuszczalnik i plastyfikacja, pracownicy mogą przedstawić podrażnienie skóry z powodu ostrej (krótkoterminowe narażenie) przez obecność tych związków.
Nie ma informacji na temat przewlekłych efektów (w perspektywie długoterminowej) lub rozwoju rakotwórczych u ludzi. Według Agencji Ochrony Środowiska Stanów Zjednoczonych (EPA) acetamid nie jest klasyfikowany jako rakotwórczy.
Może ci służyć: bez elektrolitów: cechy i przykładyMiędzynarodowa Agencja ds. Badań Raka sklasyfikowała acetamid jako grupę 2B, możliwy rakotwórczy ludzki.
Kalifornijska Agencja Ochrony Środowiska ustanowiła oszacowanie ryzyka inhalacyjnego na 2 × 10-5 µg/m3 (mikrogram na metr sześcienny) oraz ryzyko raka jamy ustnej po spożyciu 7 × 10-2 mg/kg/d (miligramo dla każdego kilograma w ciągu jednego dnia) przez długi czas.
Jednak chociaż ogólna populacja może być narażona na palenie papierosów lub kontakt skóry z produktami zawierającymi acetamid, nie stanowi dużego ryzyka ze względu na charakterystykę rozpuszczalności i higroskopii, jaką ma z wodą.
Można go łatwo przesunąć przez ziemię przez spływ, ale oczekuje się, że zostanie zdegradowany przez mikroorganizmy i nie gromadzą się u ryb.
Acetamid to lekka podrażniająca skóra i oczy i nie ma dostępnych danych, które certyfikują jego toksyczny wpływ na ludzi.
U zwierząt laboratoryjnych toksyczność zaobserwowano w utraty masy ciała, gdy podlegał bardzo wysokiej dawce doustnej w czasie. Jednak w narodzinach młodych rodziców leczonych acetamid.
Bibliografia
- Cosmos Online, (od 1995 r.), Informacje techniczne i komercyjne acetamidu, odzyskane 23 marca 2018 r., Cosmos.com.MX
- Morrison, r., Boyd, r., (1998), Organic Chemistry (wydanie 5), Meksyk, Inter -American Educational Fund, S.A de c.V
- Pine, s., Hammond, g., Cram, d., Hendrickson, J., (1982). Chemia organiczna, (wydanie drugie), Meksyk, McGraw-Hill de México, S.A de c.V
- Chemical Guide, (2013), zastosowania acetamidu, odzyskane 24 marca 2018 r., Guiadeproductosquimicos.Blogspot.com.współ
- National Center for Biotechnology Information. Baza danych złożona Pubchem; CID = 178, acetamid. Odzyskany Pubchem.NCBI.NLM.Nih.Gov

