Podstawowa struktura cech
- 2802
- 880
- Arkady Sawicki
Struktura pierwotna białek Jest to kolejność, w jakiej ułożone są aminokwasy polipeptydów. Białko jest biopolimerem utworzonym przez monomery α-aminokwasowe zjednoczone przez wiązania peptydowe. Każde białko ma określoną sekwencję tych aminokwasów.
Białka wykonują ogromną różnorodność funkcji biologicznych, w tym kształt i utrzymanie integralności komórek przez cytoszkielet, bronią organizmu dziwnych środków przez przeciwciała i katalizują reakcje chemiczne organizmu przez enzymy.
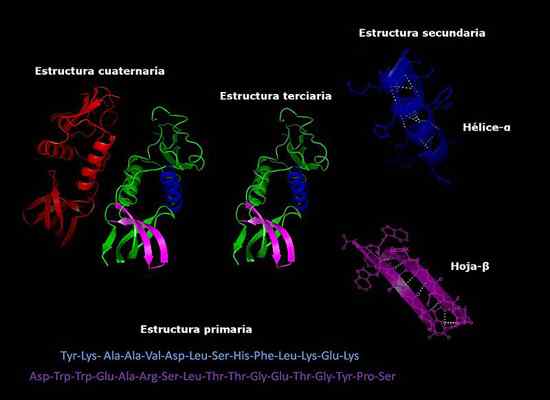
 Pierwotne, wtórne, trzeciorzędowe i czwartorzędowe struktury białek, trójwymiarowa konformacja. Zrobione i zredagowane z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Pierwotne, wtórne, trzeciorzędowe i czwartorzędowe struktury białek, trójwymiarowa konformacja. Zrobione i zredagowane z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Obecnie określenie składu białek i kolejności, w której aminokwasy (sekwencjonowanie) jest szybsze niż lata temu. Informacje te są zdeponowane w międzynarodowych elektronicznych bazach danych, do których można uzyskać dostęp przez Internet (między innymi Genbank, PIR).
[TOC]
Aminokwasy
Aminokwasy to cząsteczki zawierające grupę aminową i grupę kwasu karboksylowego. W przypadku α-aminokwasów mają one centralny atom węgla (węglowy α), do którego są one zjednoczone, zarówno grupa aminowa, jak i grupa karboksylowa, oprócz atomu wodoru i charakterystycznej grupy R, która nazywa się bocznymi łańcuch.
Z powodu tej konfiguracji węgla α, aminokwasy, które powstają, znane jako α-aminokwasy, są chiralami. Istnieją dwie formy, które są lustrzanymi obrazami i które są nazywane enancjomerami L i D.
Wszystkie białko żywych istot powstają w wyniku konfiguracji 20 α-aminokwasów L. Łańcuchy boczne tych 20 aminokwasów są różne i mają dużą różnorodność grup chemicznych.
Zasadniczo α-aminokwasy można grupować (dowolnie) w zależności od rodzaju łańcucha bocznego w następujący sposób.
Alifatyczne aminokwasy
W tej grupie są one zawarte, według niektórych autorów, glicyna (GLI), alanina (skrzydło), valine (val), leucina (leu) i izoleucyny (ile). Inni autorzy obejmują również metioninę (MET) i proline (PRO).
Może ci służyć: fosfolipidy: cechy, struktura, funkcje, typyAminokwasy z łańcuchami bocznymi zawierającymi hydroksyl lub siarkę
Zawiera serynę (Ser), cysteinę (CYS), Treonina (THR), a także metioninę. Według niektórych autorów grupa powinna obejmować tylko bycie i thr.
Cykliczne aminokwasy
Zintegrowane tylko przez prolinę, która, jak już wspomniano, jest uwzględniony przez innych autorów wśród aminokwasów alifatycznych.
Aromatyczne aminokwasy
Fenyloalanina (PHE), tyrozyna (Tyr) i Triphafano (TRP).
Podstawowe aminokwasy
Histydyna (jego), lizyna (Lys) i Arginina (arg)
Kwaśne aminokwasy i jego amidy
Zawiera kwasy asparaginowe (ASP) i glutamiczne (Glu), a także aspargininy (ASN) i glutaminy (GLN). Niektórzy autorzy podzielają tę ostatnią grupę na dwie; Z jednej strony kwaśnych aminokwasów (pierwsze dwa), a z drugiej osoby zawierające karboksyloamid (pozostałe dwa).
Linki peptydowe
Aminokwasy mogą przyłączać się do siebie poprzez połączenia peptydowe. Linki te, zwane również linkami amida, są ustalane między grupą α-amino jednego aminokwasu a grupą α-karboksylową innej innej. Ten związek powstaje wraz z utratą cząsteczki wody.
Związek między dwoma aminokwasami powoduje utworzenie dipéptide, a jeśli dodano nowe aminokwasy, sekwencyjnie, TRIDID, TETRAPEPTIDY i tak dalej.
Polipeptydy utworzone przez niewielką liczbę aminokwasów, otrzymują ogólną nazwę oligopeptydów, a jeśli liczba aminokwasów jest wysoka, wówczas nazywane są polipeptydy.
Każdy aminokwas, który jest dodawany do łańcucha polipeptydowego, uwalnia cząsteczkę wody. Część aminokwasów, która straciła H+ lub OH- podczas związku, nazywa się resztą aminokwasów.
Większość tych łańcuchów oligopeptydowych i polipeptydowych wystąpi na jednym końcu grupy amino-końcowej (N-końcowej), a w drugiej końcowej karboksylu (C-końcowej). Oprócz tego mogą zawierać wiele grup jonizowanych między łańcuchami bocznymi odpadów aminokwasowych, które je zawierają. Z tego powodu rozważane są polianfolity.
Może ci służyć: flora i fauna Campeche: reprezentatywne gatunki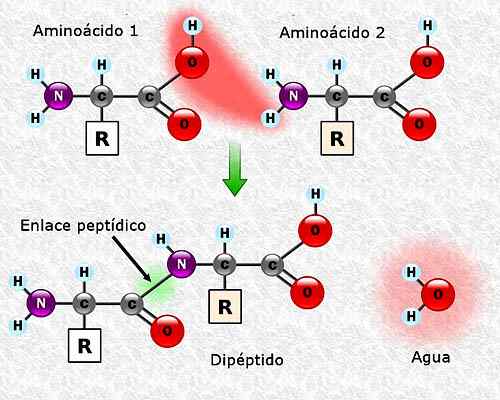 Tworzenie łącza peptydu między dwoma aminokwasami. Zrobione i zredagowane z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Tworzenie łącza peptydu między dwoma aminokwasami. Zrobione i zredagowane z: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Sekwencja aminokwasowa
Każde białko ma pewną sekwencję odpadów aminokwasowych. Ten porządek jest tak zwany podstawową strukturę białka.
Każde białko każdego organizmu jest specyficzne dla gatunku. Oznacza to, że mioglobina istoty ludzkiej jest identyczna z inną istotą ludzką, ale ma niewielkie różnice z mioglobinami innych ssaków.
Ilość i rodzaje aminokwasów, które zawiera białko, są równie ważne, jak lokalizacja tych aminokwasów w łańcuchu polipeptydowym. Aby poznać białka, biochemicy muszą najpierw izolować i oczyścić każde konkretne białko, a następnie dokonać analizy zawartości aminokwasów, a ostatecznie określić jego sekwencję.
W celu izolacji i oczyszczania białek istnieją różne metody, wśród nich: wirowanie, chromatografia, filtracja żelowa, dializa i ultrafiltracja, a także zastosowanie właściwości rozpuszczalności białka w badaniu w badaniu.
Określenie aminokwasów obecnych w białkach przeprowadza się po trzech krokach. Pierwszym z nich jest złamanie wiązań peptydowych przez hydrolizę. Następnie różne typy aminokwasów z mieszaniny są oddzielone; I wreszcie, każdy z rodzajów uzyskanych aminokwasów jest określany ilościowo.
Aby określić podstawową strukturę białka, można zastosować różne metody; Ale obecnie najczęściej stosowana jest metoda Edmana, która zasadniczo składa się z znakowania i oddzielenia N-końcowego aminokwasu od reszty łańcucha wielokrotnie i identyfikacja każdego aminokwasu uwalnianego indywidualnie.
Kodowanie białka
Podstawowa struktura białek jest kodowana w genach organizmu. Informacje genetyczne są zawarte w DNA, ale w przypadku translacji białka należy najpierw transkrybować do cząsteczek RNM. Każdy trójbole nukleotydowe (kodon) koduje aminokwas.
Może ci służyć: jaki jest skład chemiczny żywych istot?Ponieważ istnieje 64 możliwe kodony, a w budowie białek stosuje się tylko 20 aminokwasów, każdy aminokwas może być kodowany przez więcej niż jeden kodon. Praktycznie wszystkie żywe istoty używają tych samych kodonów do kodowania tych samych aminokwasów. Dlatego kod genetyczny jest uważany za prawie uniwersalny język.
W tym kodzie istnieją kodony używane do rozpoczęcia, a także zatrzymania tłumaczenia polipeptydowego. Kodony ukończenia nie kodują żadnego aminokwasu, ale zatrzymują tłumaczenie na łańcuch C-końcowy i są reprezentowane przez trojaczki UAA, UAG i UGA.
Z drugiej strony kodon AUR normalnie działa jako sygnał startowy, a także koduje metioninę.
Po tłumaczeniu białka mogą ponieść pewne przetwarzanie lub modyfikację, takie jak krótkie umorzenie, aby osiągnąć swoją ostateczną konfigurację.
Bibliografia
- C.K. Mathews, k.I. Van Hold & K.G. Ahern. 2002. Biochemery. 3th Wydanie. Benjamin / Cummings Publishing Company, Inc.
- Murray, s. 1. Mayes, d.C. Granner i V.W. Rodwell. 1996. Biochemeryka Harpera. Appleton i Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (SF). Biochemery. 5th Wydanie. W. H. Freeman and Company.
- J. Koolman i k.-H. Roehm (2005). Atlas koloru biochemii. 2Nd Wydanie. Thieme.
- DO. Lehninger (1978). Biochemia. Omega Editions, S.DO.
- L. Stryer (1995). Biochemery. W.H. Freeman and Company, Nowy Jork.
- « Historia liczb Avogadro, jednostki, sposób obliczania, używa
- Charakterystyka egzonukleazy, struktura i funkcje »

