Widmo absorpcyjne

- 4931
- 248
- Pani Gilbert Stolarczyk
 Widmo światło widzialne. Źródło: Wikimedia Commons
Widmo światło widzialne. Źródło: Wikimedia Commons Co to jest widmo absorpcyjne?
A Widmo absorpcyjne Jest to produkt interakcji światła z materiałem lub substancją w dowolnym z jego stanów fizycznych. Interakcja obejmuje szeroki odcinek zakresu długości fal i energii promieniowania elektromagnetycznego.
Innymi słowy, widmo absorpcyjne odzwierciedla to ułamek promieniowania elektromagnetycznego, że pewien materiał pochłania w zakresie częstotliwości.
W tym sensie niektóre ciała stałe, cieczy lub gazów mogą wchłaniać fotony o różnych energiach lub długościach fali, od promieniowania ultrafioletowego, a następnie światła widzialnego, po promieniowanie lub światło podczerwieni, oszałamiające w długości fali mikrofalowej.
Ludzkie oko postrzega tylko interakcje materii z widzialnym światłem. Jest także w stanie zastanowić się nad dyfrakcją białego światła przez pryzmat lub medium w jego kolorowych komponentach (obraz doskonały).
Jeśli promień światła jest „złapany” po przejściu przez materiał i przeanalizowany, znaleziono brak niektórych kolorowych pasm. Oznacza to, że czarne paski byłyby obserwowane kontrastujące z jego tłem.
Jest to widmo absorpcyjne, a jego analiza ma fundamentalne znaczenie w instrumentalnej chemii analitycznej i astronomii.
Absorpcja atomowa
Na górnym obrazie pokazano typowe widmo absorpcji pierwiastków lub atomów. Należy zauważyć, że czarne paski reprezentują wchłonięte długości fali, podczas gdy inne są emitowane. Oznacza to, że wręcz przeciwnie, atomowe spektrum transmisji wyglądałoby jak czarny zespół z emitowanymi kolorami.
Ale jakie są te paski? Jak wiedzieć, czy atomy wchłaniają lub emitują (bez wprowadzania fluorescencji lub fosforescencji)? Odpowiedzi są w stanach elektronicznych dozwolonych przez atomy.
Może ci służyć: minimalna formuła: jak uzyskać minimalną formułę, przykłady i ćwiczeniaPrzejścia elektroniczne i energia
Elektrony są w stanie odejść od jądra, pozostawiając go pozytywnie załadowane podczas podróży z niższej orbity energii do jednej z większej energii. Aby to zrobić, wyjaśnione przez fizykę kwantową, pochłaniaj fotony energii określonej do wykonania wspomnianego przejścia elektronicznego.
Dlatego energia jest kwantyzowana i nie wchłania medium ani trzech czwartych fotonu, ale wartości częstotliwości (ν) lub konkretnych długości fali (λ).
Gdy elektron jest podekscytowany, nie pozostaje nieograniczony w stanie elektronicznym większej energii. Uwolnij energię w postaci fotonu, a atom powraca do stanu podstawowego lub oryginalnego.
W zależności od tego, czy zarejestrowane są fotony, nastąpi widmo absorpcji. A jeśli wyemitowane fotony zostaną zarejestrowane, wówczas wynikiem będzie widmo emisji.
Zjawisko to można zaobserwować eksperymentalnie, jeśli miękkie lub atomizowane próbki są ogrzewane z elementu. W astronomii, porównując te widma, skład gwiazdy można znać, a nawet jej lokalizacja związana z Ziemią.
Widmo widoczne
Jak widać na obrazie, widmo widzialne zawiera kolory od fioletu do czerwonego i wszystkie jego odcienie w odniesieniu do tego, ile materiału wchłania (ciemne niuanse).
Długości fali czerwonego światła odpowiadają wartościom od 650 nm dalej (aż do zniknięcia w promieniowaniu podczerwieni).
A po lewym końcu fioletowe i fioletowe tony pokrywają wartości długości fali do 450 nm. Widmo widoczne obejmuje następnie od 400 do około 700 nm.
Wraz ze wzrostem λ częstotliwość fotonu zmniejsza się, a zatem jego energia. Zatem światło fioletowe ma większą energię (niższe długości fali) niż światło czerwone (wyższe długości fali).
Może ci służyć: brom: historia, struktura, konfiguracja elektroniczna, właściwości, użyciaDlatego materiał pochłaniający fioletowe światło implikuje elektroniczne przejścia większych energii.
Kiedy materiał pochłania fioletowy kolor, będzie nosił zielonkawy żółty kolor, co oznacza, że jego elektrony wykonują bardzo przejścia energetyczne. A kiedy materiał pochłania czerwony kolor, o mniejszej energii, będzie odzwierciedlał niebieskawy zielony kolor.
Gdy atom jest bardzo stabilny, zwykle przedstawia bardzo odległe stany elektroniczne w energii, a zatem będzie musiał wchłonąć fotony o większej energii, aby umożliwić przejścia elektroniczne:
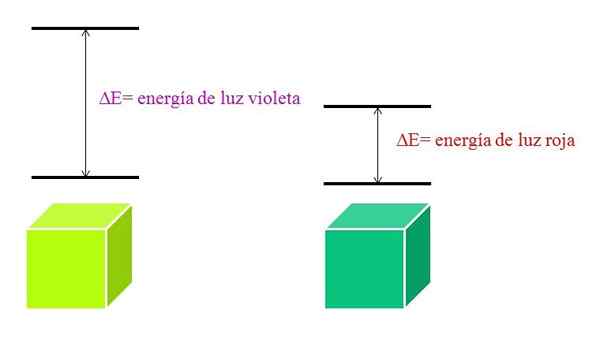 Schemat energii fioletowego światła i czerwonego światła. Źródło: Gabriel Bolívar
Schemat energii fioletowego światła i czerwonego światła. Źródło: Gabriel Bolívar Widmo absorpcji cząsteczek
Cząsteczki mają atomy, a także pochłaniają promieniowanie elektromagnetyczne. Jednak ich elektrony są częścią wiązania chemicznego, więc ich przejścia są różne. Jednym z wielkich triumfów teorii orbity molekularnej jest możliwość powiązania widm absorpcyjnych ze strukturą chemiczną.
Zatem proste, podwójne, potrójne, sprzężone ogniwa i struktury aromatyczne, mają swoje własne stany elektroniczne, pochłaniając bardzo specyficzne fotony.
Posiadając kilka atomów, oprócz interakcji międzycząsteczkowych i wibracji ich połączeń (które również pochłaniają energię), widma absorpcyjne cząsteczek mają kształt „gór”, które wskazują pasma zawierające długości fal, w których przejścia elektroniczne przejścia.
Dzięki tym widmom związek można scharakteryzować, identyfikować, a nawet poprzez analizę wielowymiarową, określić ilościowo.
Błękit metylenowy
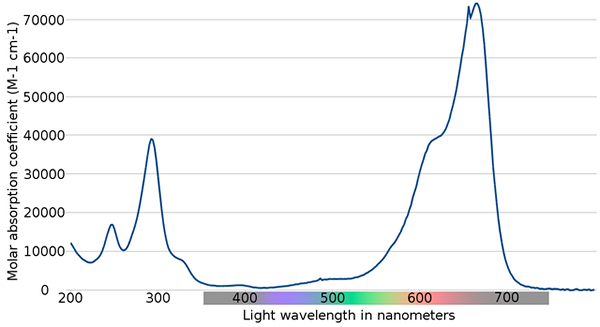 Widmo niebieskie metylenowe. Źródło: Wikimedia Commons
Widmo niebieskie metylenowe. Źródło: Wikimedia Commons Na górnym obrazie pokazano widmo niebieskiego wskaźnika metylenu. Jak zauważa nazwa, jest niebieski, ale można go sprawdzić za pomocą widma absorpcyjnego?
Może ci służyć: zmiany fizyczneNależy zauważyć, że istnieją pasma między długościami fali 200 i 300 nm. Od 400 do 500 nm prawie nie ma absorpcji, to znaczy nie wchłania fioletowych, niebieskich ani zielonych kolorów.
Jednak przedstawia intensywne pasmo absorpcji po 600 nm, a zatem ma niskie przejścia elektroniczne o niskiej energii, które pochłaniają fotony z czerwonego światła.
W konsekwencji, biorąc pod uwagę wysokie wartości chłodności trzonowców, błękit metylenowy wykazuje intensywny niebieski kolor.
Chlorofil A i B
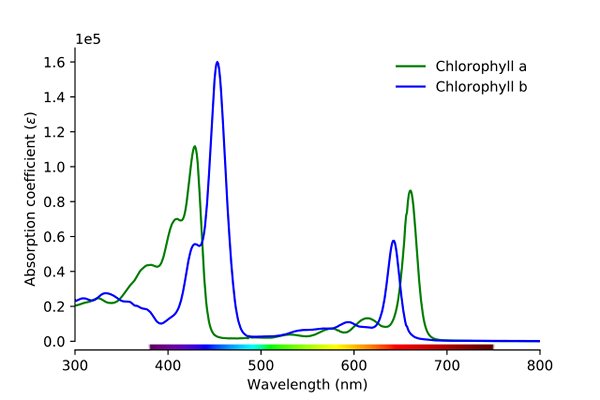 Widmo absorpcji chlorofilu A i B. Źródło: Wikimedia Commons
Widmo absorpcji chlorofilu A i B. Źródło: Wikimedia Commons Jak widać na obrazie, zielona linia odpowiada widmowi chlorofilu A.
Po pierwsze, pasma, w których pochłanianie trzonowe są wyższe, w tym przypadku te, które znajdują się po lewej stronie, między 400 a 500 nm. Chlorofil A intensywnie pochłaniające fioletowe kolory, podczas gdy chlorofil B (niebieska linia) robi to niebieskim kolorem.
Poprzez pochłanianie chlorofilu B około 460 nm (niebieski), żółty kolor jest odbity. Z drugiej strony również intensywnie pochłania około 650 nm, pomarańczowe światło, co oznacza, że pokazuje kolor niebieski. Jeśli mieszane są żółte i niebieskie, powoduje to zielony kolor.
I wreszcie chlorofil A wchłania niebieskawy fioletowy kolor, a także czerwone światło około 660 nm. Dlatego wykazuje zielony „miękki” kolor według żółtego.
Bibliografia
- Observatoire de Paris (s.F.). Różne rodzaje widm. Źródło: średnio 4.OSPPM.Fr
- RANALS University Campus (S.F.). Spektrofometria: widma absorpcyjne i kolorymetryczna kwantyfikacja biomolekuł. UCO odzyskało.Jest

